写在前面的话:上上个月跟着刘老师做了一次RNA提取,然后今天在老师的监督下进行练习,过程惨不忍睹,记录一下引以为戒。
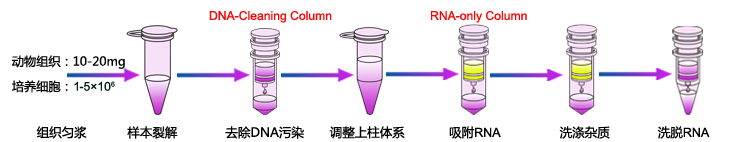
RNA提取流程(图片来源于网络,仅供学习交流用)
1.工作液配制
①Buffer RLT 工作液:根据实验用量配置,工作液比例10ml Buffer RLT 中加入100μl巯基乙醇;
错误:巯基乙醇在通风橱里面使用,在外面打开像开了毒气弹。
②Dnase混合液(按照说明标注稀释DNaseⅠ储存液,单个样本需要量——取10μl DNaseⅠ储存液混合70μl Buffer RDD);
错误1:在Buffer RDD第一次移取时贴壁加液,然后继续移取下一步样品,有污染Buffer RDD的可能;
错误2:混匀时涡旋混匀,与说明书的规定不一致(Mix gently by inverting。DO not vortex),可能会引起Dnase I 变性(denaturation)。
③Buffer RPE工作液(1ml Buffer RPE 加入4ml无水乙醇)
④70%乙醇;
⑤80%乙醇
失误:三次实验均用到无水乙醇,没有先移取无水乙醇然后移取其他液体,整体实验效率降低。
原因:试验前未规划。
2.供试品取样
1)供试品取样应当具有代表性
产品、中间产品产生细胞悬液直接取得供试品细胞。
2)细胞类制品原辅料的的检验数量及检验量
送检供试品细胞检验量不低于2×105细胞数量,注明细胞数量。每个供试品送检验数量以2或3为适。最低送检验数量1。
3)供试品处理及转移
按照细胞培养工艺传代等同条件获得细胞沉淀,使用1.5ml规格无菌离心管转移。短暂存放4℃,冰上转移。长时间存放-80℃冷冻保存,干冰长途转移。
错误:未注意冰上转移,手拿样品。
原因:除没看文件外,还有知识盲区,细胞死亡过程可能会释放各种酶导致RNA被降解,低温将此可能降到最低。其次手很热没注意过。
3.供试品RNA提取
按照以下步骤,提取RNA:
1)RNA提取试剂盒,部分试剂需提前准备工作液;
错误1:按顺序进行溶液配制,未进行规划,其次未考虑使用顺序。
正确操作1:优先配制工作液后制备细胞沉淀。如未及时配制优先配制Buffer RLT 工作液,在完成沉淀制备及时加入Buffer RLT 工作液进行裂解保护目标RNA。
错误2:未正确标记离心管同时及时书写记录。
正确操作2:在记录中根据样品序号写好样品名称,然后在待用管上标记样品序号(如1、2、3....)。注意最终样品要标记名称。
2)RNA提取步骤
细胞沉淀(如为细胞悬液,离心600g,8min,去除上清)加入350μl Buffer RLT 工作液。吹打混匀。
错误1:使用1mL枪头进行吹打,可能会导致RNA被枪头过多吸附。
正确操作1:使用0.2mL枪头吹打减少吸附,吹打时注意避免污染滤芯,少吸轻吹混匀即可。着重对沉淀进行吹打,不必整管混匀,因为后续步骤会有混匀的作用。
错误2:移液枪盒离废液槽过近,容易被污染。
正确操作2:实验现场合理布局,例如分三区,洁净区域、污染区、操作区,其次对每一个区域再进行细分。
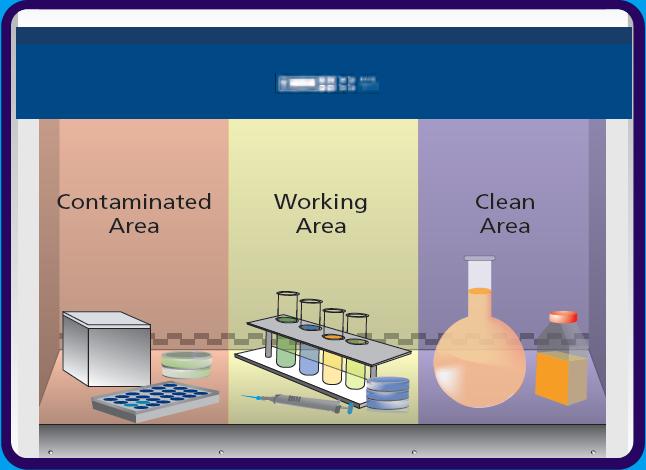
实验分区(图片来源于网络,仅供学习交流用)
错误3:贴壁加样,效率低。可以反向吸液悬空加,但需要注意不要交叉污染。
3)将以上样本按照不超过600μl体积每次,过柱子“QIA Shredder”,12000rpm,2min。回收流穿液。
错误:柱子差点用错,试验前未确认,尴了个尬。
4)加入等体积70%乙醇,吹打混匀,转移至纯化柱中,冰上静置2min。离心10000rpm,1min,弃废液。
错误:冰上静置的时候把整个管插到冰里面,冰水有可能进入到收集管中,丢人丢到姥姥家了。
5)加入350μl Buffer RW1, 10000rpm,1min,弃废液。
错误1:弃废液的时候没忍住甩了一下,此处不仅是污染还有安全问题。
错误2:倾倒废液的时候收集管与废液管口对口倾倒,容易导致交叉污染。
6)加入80μl DNase混合液。室温静置15min。加入350μl Buffer RW1, 10000rpm,1min,弃废液。更换新收集管。
错误:忙着聊天,没有加入Buffer RW1就去离心了。无语凝噎。
注意:更换新的收集管如果DNase残留会导致cDNA的降解。
7)加入500μl Buffer RPE工作液,10000rpm,1min,弃废液。
8)加入500μl 80%乙醇,10000rpm,2min,弃废液。更换新收集管。
9)开盖干燥同时进行离心,13000rpm,5min,弃废液。更换新1.5ml收集管。
10)加入18μl无核酸酶水洗脱,静置2min, 13000rpm,1min。
11)吸取收集管中水,重复洗脱步骤⑨。获得提取样本RNA溶液18μl。
错误1:吸取无核酶水的同时打开纯化柱盖,手忙脚乱还可能引入污染。
正确操作1:取出纯化柱,吸取无核酶水后将纯化柱放回然后打开盖子。
错误2:枪头碰触纯化柱的滤膜,可能会导致滤膜破损进而导致洗脱效率降低。
12)标记名称,批号。(负80度保存,备用)
4.小结
作为一个分子生物学的小白,一个QC老油子,充满敬畏却缺少足够的重视,归结起来说确实很不认真。事前没有梳理流程,前一次学习完也没有再复盘。总认为自己有很多细节还不清楚,对理论的理解不够,然后就不想迈出那蹩脚的一步,总想着完美。

我会努力的(图片来源于网络,仅供参考)
接下来要参与细胞治疗产品分析,需要学习了解的还很多,我这个QC老油子需要认真一些。
以后实验需要落实以下几点:
1)试验前进行梳理规划,明确实验流程;
2)试验前了解实验的原理;
3)认真阅读说明书,特别是使用试剂盒的时候;
4)迈出第一步,将理论学习与实践进行拆分,不能互为前提,不懂理论时候可以忠实模仿,懂了原理再复盘;没有实践时可以根据已有经验进行规划设计,学会知识迁移的才是高手。
5)认真对待每一次实验。
6)用脑子:离心机陪平时24个孔3个样品,1、9、17好过隔7个孔放样,我的狗脑子。
最后感谢雷哥,告诉自己:走点心再走点心。

