填报须知
《化学药生物等效性(BE)试验备案信息平台》主要面向新申报的化学药。按照《国家食品药品监督管理总局关于化学药生物等效性试验实行备案管理的公告》(2015年第257号)中的规定,对符合备案情形的化学药,应当进行生物等效性(BE)试验备案。
本填报说明仅针对化学药生物等效性(BE)试验备案的操作步骤,仿制药一致性评价试验备案操作步骤请参见《仿制药一致性评价试验备案填报说明》。
目录
1 用户登录
2 用户注册
3 新建备案
3.1 承诺书
3.2 伦理委员会批件
3.3 备案申请表
3.4 备案信息及相关附件
3.5 生成备案号
4 中止备案
5 撤销备案
1用户登录
打开网址http://www.chinadrugtrials.org.cn/( http://www.chinadrugtrials.org.cn/)
http://www.chinadrugtrials.org.cn/)
企业用户须使用药审中心的申请人之窗账户需要进行登录,登录方式有两种:账号密码登录和UKEY证书登录。如下图:
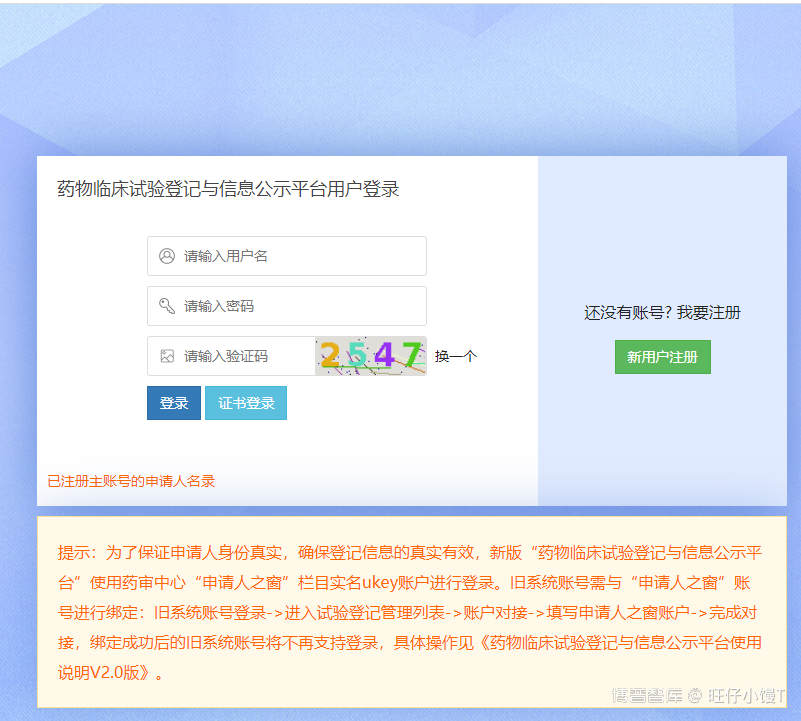
图-普通登录
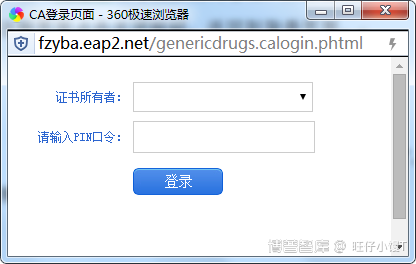
图-证书登陆
登录成功之后进入功能模块,此页面包含两部分:临床试验登记模块、备案平台模块。根据药品备案需求选择不同的备案入口。本文档主要介绍化学药生物等效性(BE)试验备案(面向新申报的化学药)的操作步骤。
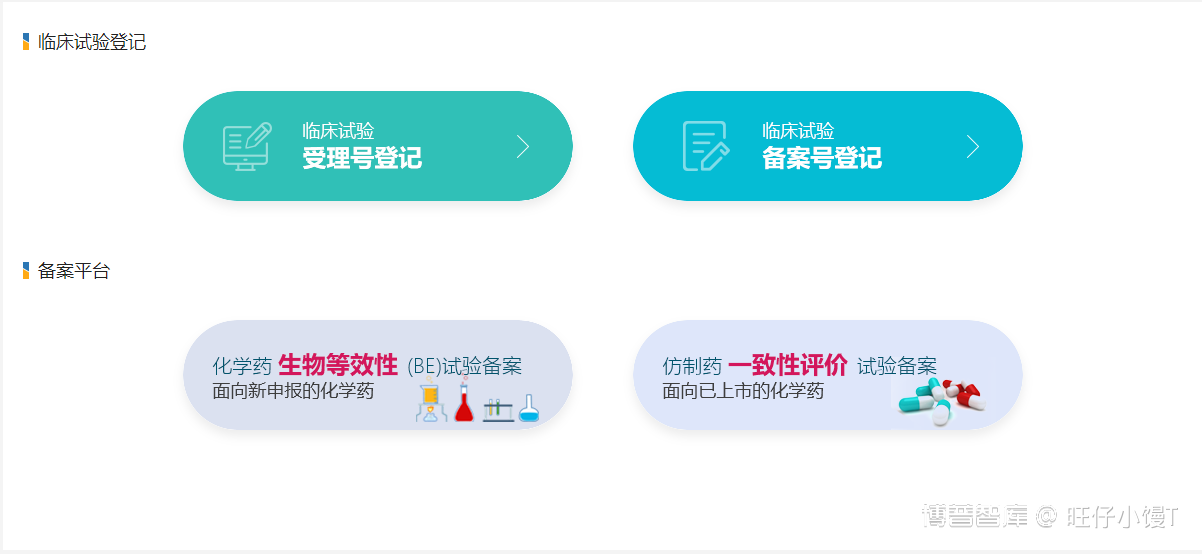
2 用户注册
如果用户未注册账号,首先在申请人之窗进行用户注册,点击登录页面右侧的“新用户注册”进入申请人之窗注册页面。
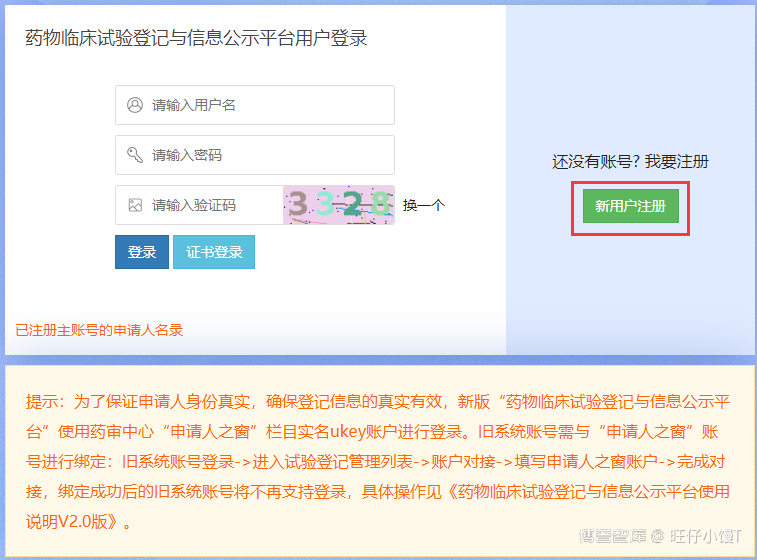
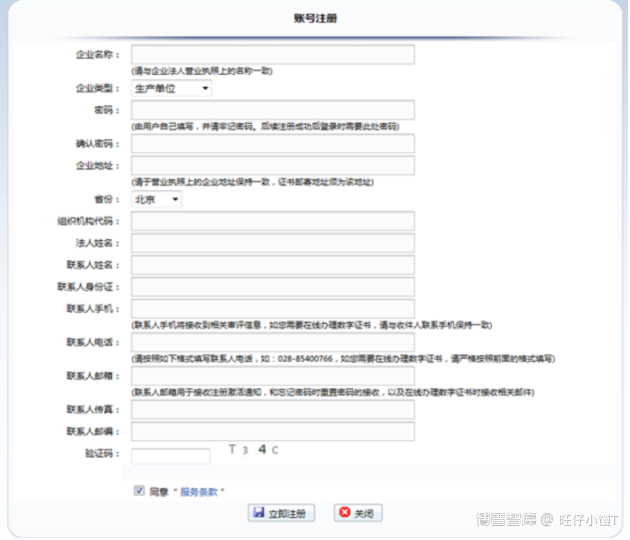
在上图中填写用户信息后,点击立即注册。
3 新建备案
备案前期准备:在网站首页或者备案信息列表页面下载备案信息表模板,按模板要求填写,并了解需要准备的相关材料附件。模板须启用宏功能,具体操作见《2007启用宏步骤》、《2010启用宏步骤》文档。
整个备案流程分为签署承诺书、上传伦理批件、填写备案申请表信息、上传备案信息表及相关附件、生成备案号
点击下载填报模板按钮,下载对应药品试验类型的备案填报模板。

可以通过备案号和药品通用名称对化学药BE试验备案记录进行查询。列表中显示备案号、药物名称、创建时间、完成时间、备案状态、操作等信息。
点击“新建备案”按钮进入备案流程。
3.1 承诺书
首先需要签署承诺书,如下图:
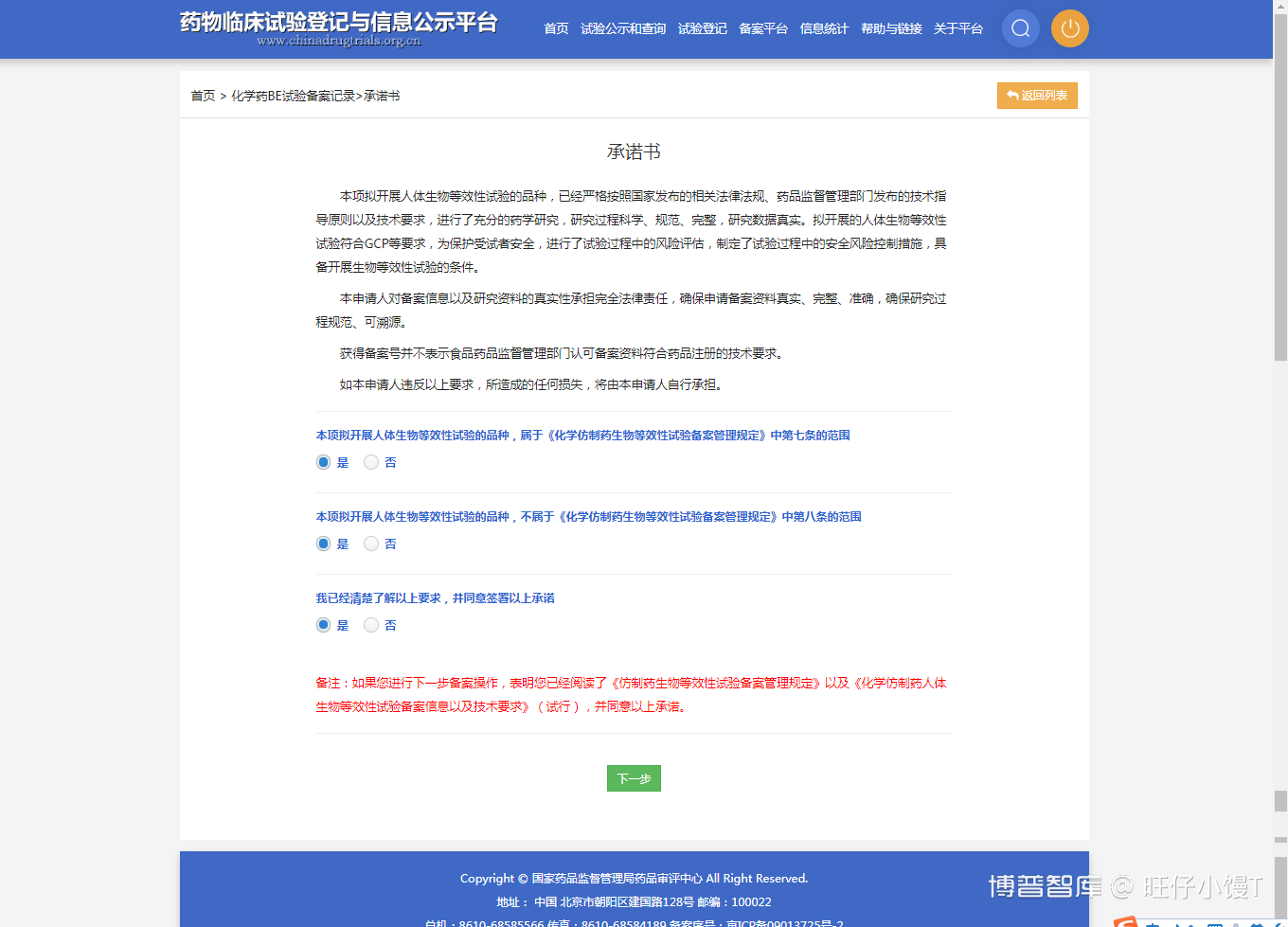
查看相应的承诺书条款,清楚了解以上要求后,在同意签署以上承诺的地方选择“是”,点击下一步进入上传伦理委员会批件页面。
3.2 伦理委员会批件
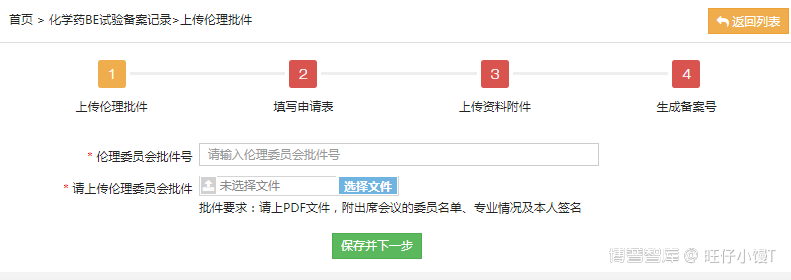
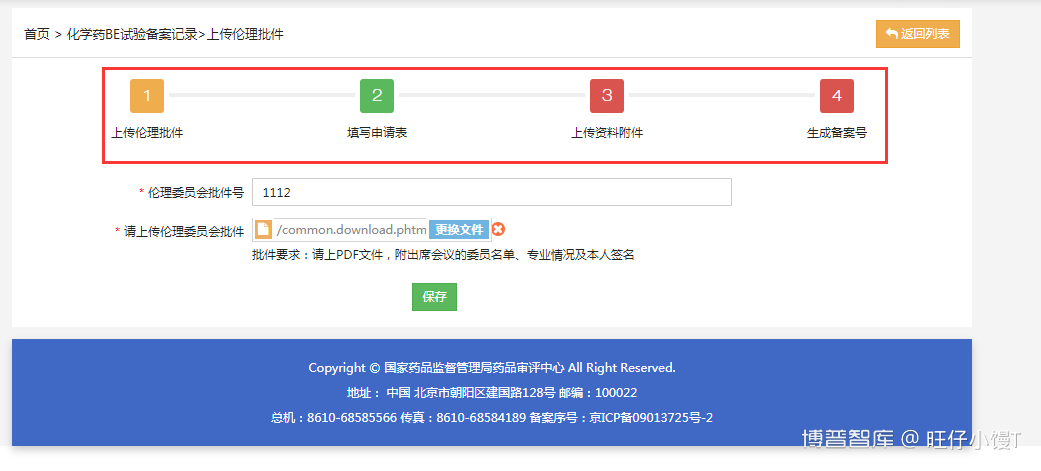
填写伦理委员会批件号,并上传批件的PDF文件,上传批件时请附出席会议的委员名单、专业情况及个人签名。填写完成后,点击“保存并下一步”。信息保存之后点击右上角的“返回列表”按钮,返回到化学药BE备案记录列表。可以看到刚才新建的备案记录。
此时的备案状态为待提交申请,点击修改备案信息进入备案信息的修改界面。在流程图中,黄色块代表当前所处的流程,红色块代表尚未完成的流程。点击对应的块可以可以进入对应的界面,流程间存在逻辑关系,前一流程完成后,才能进入下一流程。
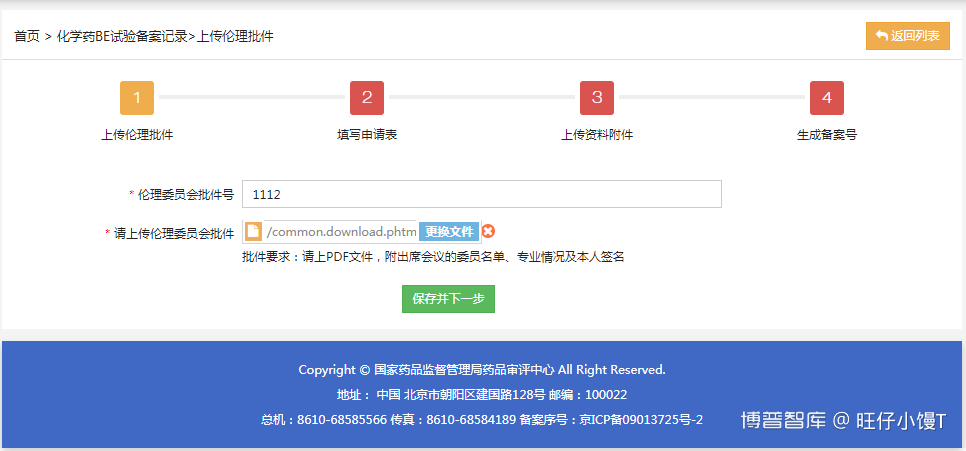
点击“填写申请表”按钮或点击流程节点2“填写申请表”进入备案申请表的填写页面。
3.3 备案申请表
备案申请表共分为四部分,包括基本信息、申请人信息、参比制剂信息和生物等效性试验信息。
1) 基本信息
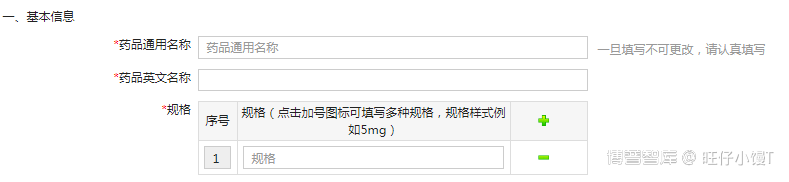
主要填写药品通用名称(一旦填写不可更改)、药品英文名称以及规格,如果有多种规格可点击加号进行增加。
注意:相同企业的相同产品(包括不同规格)应使用同一个备案号,不可重复备案。
2) 申请人信息
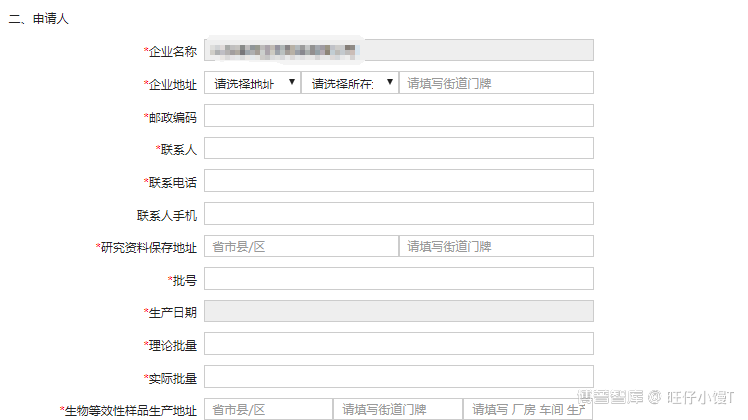
主要填写企业名称、企业地址、联系人、联系电话、研究资料保存地址、批号、生产日期、理论批量、实际批量以及生物等效性样品生产地址等信息。
注意:
如图:
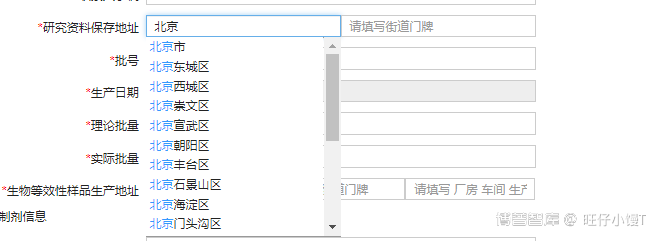
生物等效性样品生产地址最后一项须填写药品的具体生产厂房、车间、生产线等信息。
3) 參比试剂信息
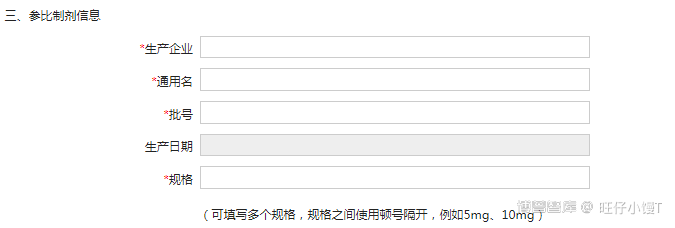
主要填写生产企业、通用名、批号、生产日期以及规格等内容。
4) 生物等效性试验信息

主要填写临床研究单位、样品检测单位、数据统计单位、报告撰写单位以及CRO单位、药学研究资料保存地址和受试制剂与参比制剂保存地址的信息,其中临床研究单位可支持多个。
需要注意的是,所有省市县地址都不可随意填写,须选择下拉框内容,否则将无法保存。检查无误后点击“保存”将进入备案资料上传页面。保存之后备案信息状态由“待提交申请表”变为“待提交资料”(若用户进入备案资料上传页面后未填写即退出备案流程,将可在备案记录列表重新进去)
点击修改备案信息进入备案信息的修改界面。在流程图中,黄色块代表当前所处的流程,绿色块代表已经完成的流程,红色块代表尚未完成的流程。点击对应的块可以可以进入对应的界面,流程间存在逻辑关系,迁移流程完成后,才能进入下一流程。选择当前节点之前的流程节点可以对之前的流程节点中的内容进行修改。
点击流程节点3上传资料附件或者是在备案列表页面点击“提交资料”按钮,进入备案摘要信息填写页面。
3.4 备案信息及相关附件
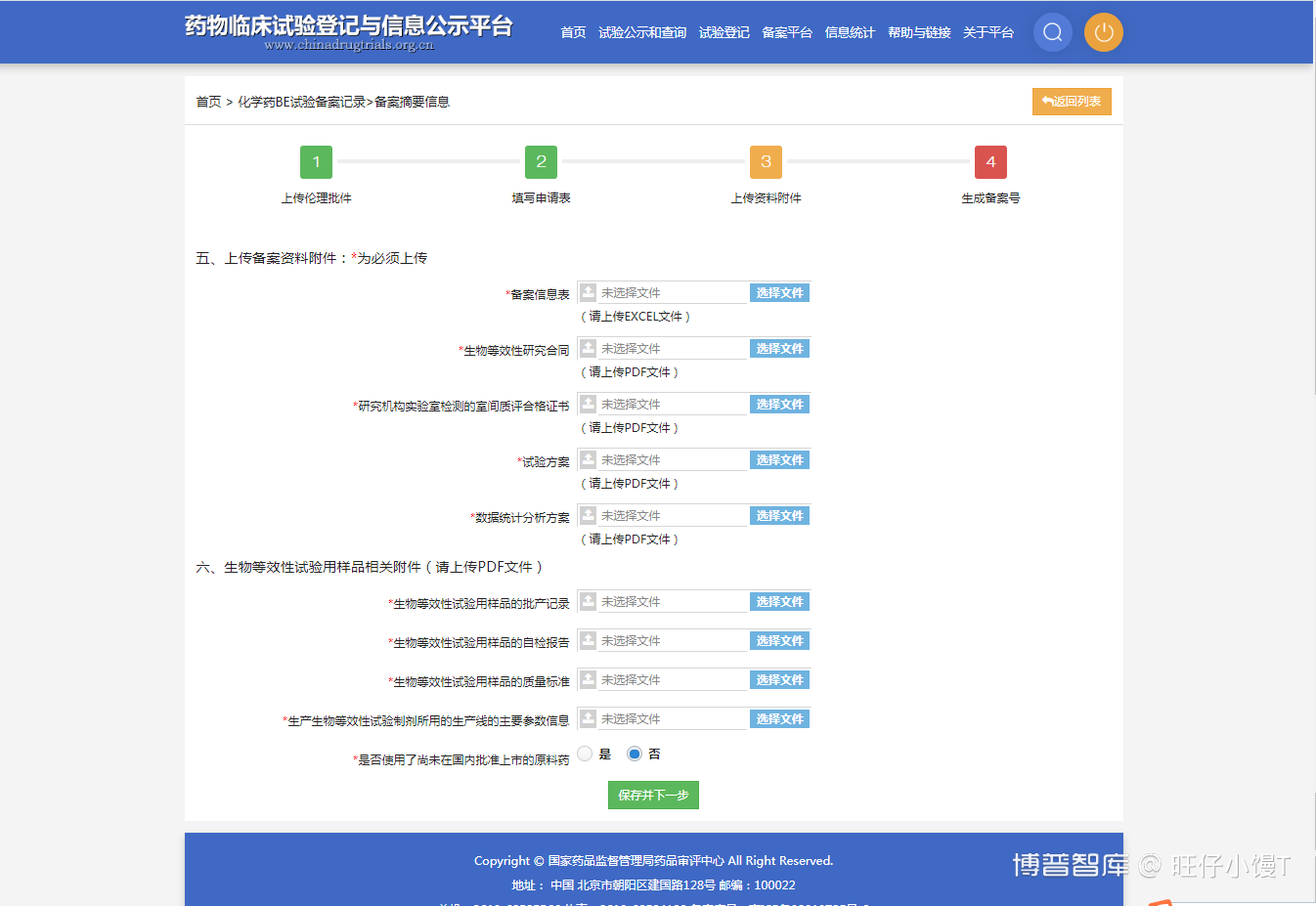
第六部分中的是否使用了尚未在国内批准上市的原料药与第七部分存在逻辑关系,如果选择否不需要填写第七部分的内容,如果选择是则需要填写第七部分的内容。
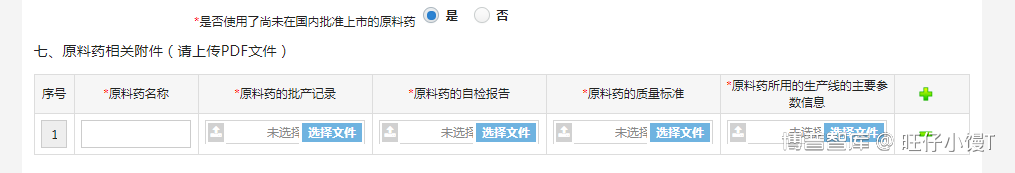
第七部分为可拓展表格,如果有多种原料药,可以点击表格右侧的“+”增加填写框。也可以点击表格右侧的“-”删除多余的填写框。

填写完成后,点击“保存并下一步”。
点击“返回列表”按钮,进入备案记录列表页,此时的备案状态为待生成备案号。
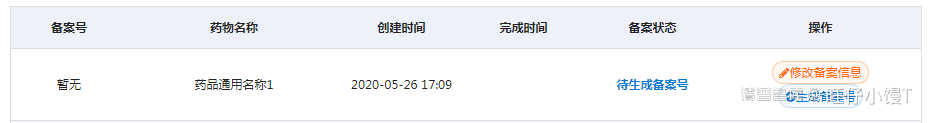
点击“生成备案号”按钮,进入生成备案号界面。
3.5 生成备案号
生成备案号必须使用ukey验证身份信息,点击“确认并生成备案号”将弹出证书登录页面。
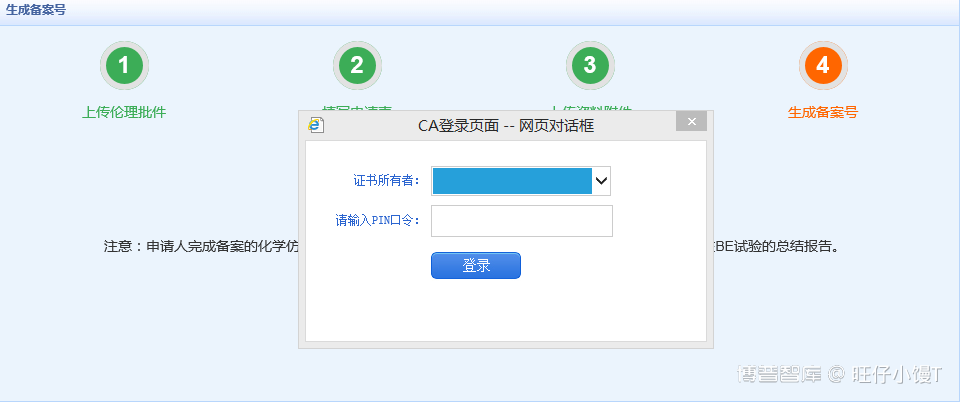
点击登录将确认备案人身份,确认成功后直接生成备案号。备案信息状态由“待生成备案号”变为“已备案”。
备案号生成后客户将无法修改备案信息。如修改须中止该备案记录再重新备案。
4 中止备案
BE试验过程中,需要对原备案资料中原研药、原料药、制剂处方、工艺等进行变更,申请人应停止该BE试验,中止备案记录并上传总结报告,并提交备案变更资料重新备案,生成新的备案号后重新开展BE试验。
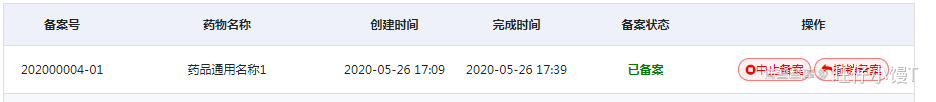
点击“中止备案”按钮,弹出对话框:上传中止总结报告文件。
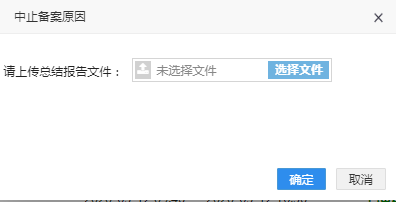
上传完成后点击确定,将提交保存报告文件,备案信息状态由“已备案”变为“备案中止”。点击查看原因按钮,弹出原因查看的窗口,点击总结报告下载,可以下载总结报告。

点击“重新备案”,对该药品进行重新备案,操作与新建备案一致。。
5 撤销备案
BE试验过程中,发现存在缺陷和风险的,申请人应撤销该BE试验,并上传总结报告。

点击“撤销备案”按钮,弹出对话框:上传撤销总结报告文件。
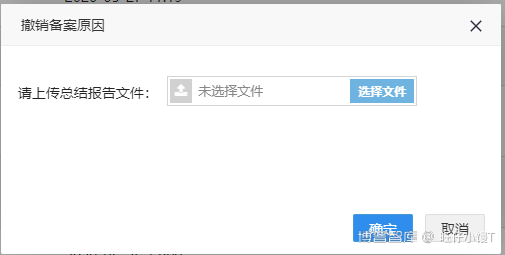
上传文件并点击确定后,完成撤销备案。备案状态为“备案撤销”,并显示了撤销备案的时间。

点击查看原因按钮,弹出原因查看的窗口,点击总结报告下载,可以下载总结报告。

文章来源:临语堂

