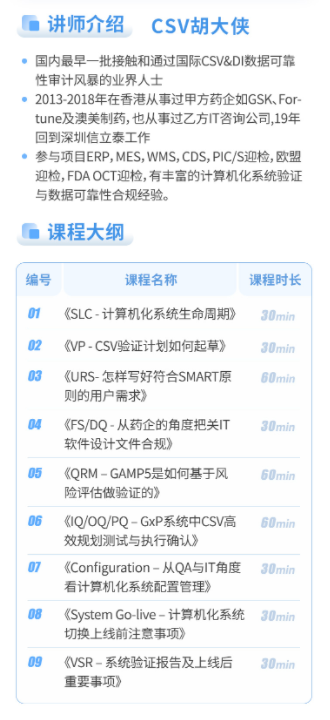
【法规汇总脑图】点击阅读原文:计算机化系统相关法规汇总( 计算机化系统相关法规汇总)
计算机化系统相关法规汇总)
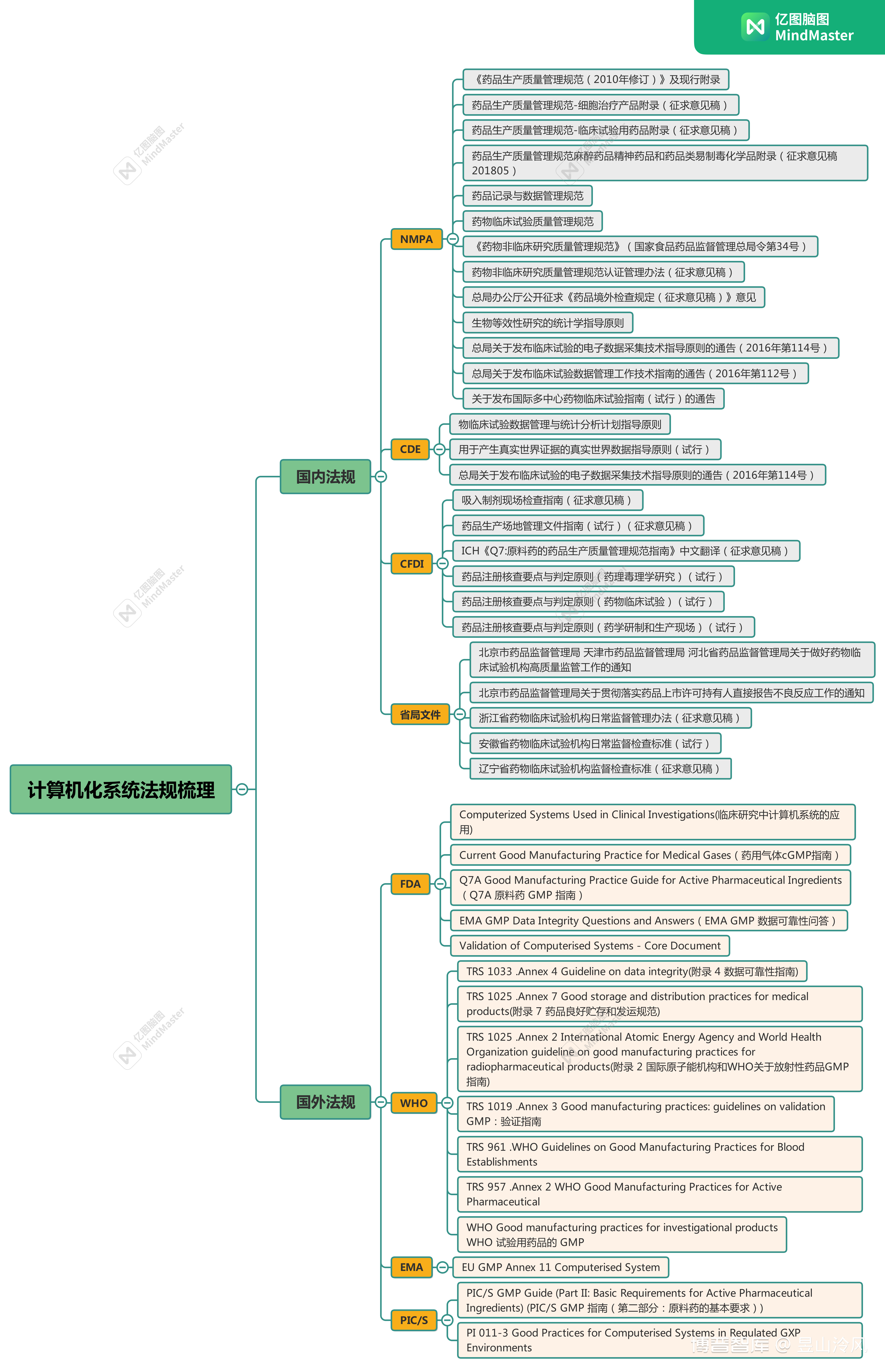
相关法规:
NMPA:药品生产质量管理规范(2010年修订)( 药品生产质量管理规范(2010年修订))药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》(2022年)(
药品生产质量管理规范(2010年修订))药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》(2022年)( 药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》(2022年))药品生产质量管理规范—临床试验用药品附录(征求意见稿)(2022年)(
药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》(2022年))药品生产质量管理规范—临床试验用药品附录(征求意见稿)(2022年)( 药品生产质量管理规范—临床试验用药品附录(征求意见稿)(2022年))药品生产质量管理规范麻醉药品精神药品和药品类易制毒化学品附录(征求意见稿(
药品生产质量管理规范—临床试验用药品附录(征求意见稿)(2022年))药品生产质量管理规范麻醉药品精神药品和药品类易制毒化学品附录(征求意见稿( 药品生产质量管理规范麻醉药品精神药品和药品类易制毒化学品附录(征求意见稿)药品记录与数据管理要求(试行)(2020年)(
药品生产质量管理规范麻醉药品精神药品和药品类易制毒化学品附录(征求意见稿)药品记录与数据管理要求(试行)(2020年)( 药品记录与数据管理要求(试行)(2020年))药物临床试验质量管理规范(2020年修订)(
药品记录与数据管理要求(试行)(2020年))药物临床试验质量管理规范(2020年修订)( 药物临床试验质量管理规范(2020年修订))《药物临床试验质量管理规范》解读(
药物临床试验质量管理规范(2020年修订))《药物临床试验质量管理规范》解读( 《药物临床试验质量管理规范》解读)药物非临床研究质量管理规范(2017年)(
《药物临床试验质量管理规范》解读)药物非临床研究质量管理规范(2017年)( 药物非临床研究质量管理规范(2017年))药品生产质量管理规范认证管理办法(2011年修订)(
药物非临床研究质量管理规范(2017年))药品生产质量管理规范认证管理办法(2011年修订)( 药品生产质量管理规范认证管理办法(2011年修订))总局办公厅公开征求《药品境外检查规定(征求意见稿)》意见(
药品生产质量管理规范认证管理办法(2011年修订))总局办公厅公开征求《药品境外检查规定(征求意见稿)》意见( 总局办公厅公开征求《药品境外检查规定(征求意见稿)》意见)生物等效性研究的统计学指导原则(
总局办公厅公开征求《药品境外检查规定(征求意见稿)》意见)生物等效性研究的统计学指导原则( 生物等效性研究的统计学指导原则)总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号)(
生物等效性研究的统计学指导原则)总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号)( 总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号))总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号)(
总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号))总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号)( 总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号))国际多中心药物临床试验指南(试行)(
总局关于发布临床试验数据管理工作技术指南的通告(2016年第112号))国际多中心药物临床试验指南(试行)( 国际多中心药物临床试验指南(试行))
国际多中心药物临床试验指南(试行))
CDE药物临床试验数据管理与统计分析的计划和报告指导原则( 药物临床试验数据管理与统计分析的计划和报告指导原则)用于产生真实世界证据的真实世界数据指导原则(试行)(
药物临床试验数据管理与统计分析的计划和报告指导原则)用于产生真实世界证据的真实世界数据指导原则(试行)( 用于产生真实世界证据的真实世界数据指导原则(试行))总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号)(
用于产生真实世界证据的真实世界数据指导原则(试行))总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号)( 总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号))
总局关于发布临床试验的电子数据采集技术指导原则的通告(2016年第114号))
CFDI关于公开征求《吸入制剂现场检查指南(征求意见稿)》意见的通知( 关于公开征求《吸入制剂现场检查指南(征求意见稿)》意见的通知)关于公开征求《药品生产场地管理文件指南(试行)》意见的通知(
关于公开征求《吸入制剂现场检查指南(征求意见稿)》意见的通知)关于公开征求《药品生产场地管理文件指南(试行)》意见的通知( 关于公开征求《药品生产场地管理文件指南(试行)》意见的通知)关于公开征求ICH《Q7:原料药的药品生产质量管理规范指南》中文翻译稿意见的通知(
关于公开征求《药品生产场地管理文件指南(试行)》意见的通知)关于公开征求ICH《Q7:原料药的药品生产质量管理规范指南》中文翻译稿意见的通知( 关于公开征求ICH《Q7:原料药的药品生产质量管理规范指南》中文翻译稿意见的通知)药品注册核查要点与判定原则(药理毒理学研究).docx(
关于公开征求ICH《Q7:原料药的药品生产质量管理规范指南》中文翻译稿意见的通知)药品注册核查要点与判定原则(药理毒理学研究).docx( 药品注册核查要点与判定原则(药理毒理学研究).docx)药品注册核查要点与判定原则(药物临床试验).docx(
药品注册核查要点与判定原则(药理毒理学研究).docx)药品注册核查要点与判定原则(药物临床试验).docx( 药品注册核查要点与判定原则(药物临床试验).docx)药品注册核查要点与判定原则(药学研制和生产现场)(试行)(
药品注册核查要点与判定原则(药物临床试验).docx)药品注册核查要点与判定原则(药学研制和生产现场)(试行)( 药品注册核查要点与判定原则(药学研制和生产现场)(试行))
药品注册核查要点与判定原则(药学研制和生产现场)(试行))
省局文件北京市药品监督管理局 天津市药品监督管理局 河北省药品监督管理局关于做好药物临床试验机构高质量监管工作的通知( 北京市药品监督管理局 天津市药品监督管理局 河北省药品监督管理局关于做好药物临床试验机构高质量监管工作的通知)辽宁省临床试验机构监督检查标准(征求意见稿).docx(
北京市药品监督管理局 天津市药品监督管理局 河北省药品监督管理局关于做好药物临床试验机构高质量监管工作的通知)辽宁省临床试验机构监督检查标准(征求意见稿).docx( 辽宁省临床试验机构监督检查标准(征求意见稿).docx)
辽宁省临床试验机构监督检查标准(征求意见稿).docx)
国外法规
FDA:临床试验中应用计算机系统的技术指导原则( 临床试验中应用计算机系统的技术指导原则)FDA的cGMP指南(
临床试验中应用计算机系统的技术指导原则)FDA的cGMP指南( FDA的cGMP指南)Q7a原料药GMP指南(
FDA的cGMP指南)Q7a原料药GMP指南( Q7a原料药GMP指南)FDA 数据可靠性与药品 CGMP 合规问答(
Q7a原料药GMP指南)FDA 数据可靠性与药品 CGMP 合规问答( FDA 数据可靠性与药品 CGMP 合规问答)Validation of Computerised Systems – Core document(
FDA 数据可靠性与药品 CGMP 合规问答)Validation of Computerised Systems – Core document( Validation of Computerised Systems – Core document)21CFRPart11“电子数据,电子签名,审计追踪”中英对照(
Validation of Computerised Systems – Core document)21CFRPart11“电子数据,电子签名,审计追踪”中英对照( 21CFRPart11“电子数据,电子签名,审计追踪”中英对照)
21CFRPart11“电子数据,电子签名,审计追踪”中英对照)
WHO: WHO TRS1033 附录4 数据完整性指南 中英( WHO TRS1033 附录4 数据完整性指南 中英) WHO ECSPP TRS 1019 Annex 3 Good manufacturing practices - gu(
WHO TRS1033 附录4 数据完整性指南 中英) WHO ECSPP TRS 1019 Annex 3 Good manufacturing practices - gu( WHO ECSPP TRS 1019 Annex 3 Good manufacturing practices - gu)00:WHO_TRS_961(440页-全英文)(
WHO ECSPP TRS 1019 Annex 3 Good manufacturing practices - gu)00:WHO_TRS_961(440页-全英文)( 00:WHO_TRS_961(440页-全英文))4_TRS957_Annex2:Good Manufacturing Practice (GMP) Guide(
00:WHO_TRS_961(440页-全英文))4_TRS957_Annex2:Good Manufacturing Practice (GMP) Guide( 4_TRS957_Annex2:Good Manufacturing Practice (GMP) Guide)
4_TRS957_Annex2:Good Manufacturing Practice (GMP) Guide)
EMA:EMA GMP数据完整性问答(中英对照版)(2016.08)( EMA GMP数据完整性问答(中英对照版)(2016.08)) CSV&DI法规指南 EU GMP Annex11_01-2011_en(
EMA GMP数据完整性问答(中英对照版)(2016.08)) CSV&DI法规指南 EU GMP Annex11_01-2011_en( CSV&DI法规指南 EU GMP Annex11_01-2011_en)
CSV&DI法规指南 EU GMP Annex11_01-2011_en)
PIC/S:PICS原料药检查备忘( PICS原料药检查备忘)pi-011-3-recommendation-on-computerised-systems(
PICS原料药检查备忘)pi-011-3-recommendation-on-computerised-systems( pi-011-3-recommendation-on-computerised-systems)
pi-011-3-recommendation-on-computerised-systems)
推荐阅读文章:
优质文章:“性能监测/定期审查/再确认&再验证” - 计算机化系统运维方法思考( “性能监测/定期审查/再确认&再验证” - 计算机化系统运维方法思考)所有计算机化系统都需要定期备份和定期还原测试吗?(
“性能监测/定期审查/再确认&再验证” - 计算机化系统运维方法思考)所有计算机化系统都需要定期备份和定期还原测试吗?( 所有计算机化系统都需要定期备份和定期还原测试吗?)计算机化系统质量体系搭建【上】 - ISPE新指南《数据可靠性源于设计》品鉴6(
所有计算机化系统都需要定期备份和定期还原测试吗?)计算机化系统质量体系搭建【上】 - ISPE新指南《数据可靠性源于设计》品鉴6( 计算机化系统质量体系搭建【上】 - ISPE新指南《数据可靠性源于设计》品鉴6)计算机化系统质量体系搭建(中) - ISPE《数据可靠性源于设计》品鉴7(
计算机化系统质量体系搭建【上】 - ISPE新指南《数据可靠性源于设计》品鉴6)计算机化系统质量体系搭建(中) - ISPE《数据可靠性源于设计》品鉴7( 计算机化系统质量体系搭建(中) - ISPE《数据可靠性源于设计》品鉴7)完整的计算机系统生命周期的验证流程(
计算机化系统质量体系搭建(中) - ISPE《数据可靠性源于设计》品鉴7)完整的计算机系统生命周期的验证流程( 完整的计算机系统生命周期的验证流程)
完整的计算机系统生命周期的验证流程)
关注专栏 及时获取更新>>
( https://www.bopuyun.com/zhuanlan/80955957711)歪把子:实验室计算机化系统验证
https://www.bopuyun.com/zhuanlan/80955957711)歪把子:实验室计算机化系统验证
资源专题:
( https://www.bopuyun.com/zhuanti/80635402515) 专题 计算机化系统相关期刊论文
https://www.bopuyun.com/zhuanti/80635402515) 专题 计算机化系统相关期刊论文
相关问答:
免费课程:
点击课程标题进入课程页面:
( https://www.bopuyun.com/college/80937101523)(2)马祥-每天15分钟修炼CSV+数据可靠性独家内功心法
https://www.bopuyun.com/college/80937101523)(2)马祥-每天15分钟修炼CSV+数据可靠性独家内功心法

转发本文到微信社群或朋友圈,添加客服微信【BPYD2021】免费领取课程:胡大侠-从法规到应用,掌握CSV正确方法