往期回顾
中国疫苗:“7.1信息化大考”叠加新冠疫情的狂飙猛进 - 胡大侠行研1
集采化药信息化?!“浙江局的黑匣子” 想给药品生产企业卖什么药- 胡大侠行研2
5月24日,由国家药品监督管理局药品注册司国家药监局药品监管司国家药监局药审中心政策解读宣贯会
NMPA 官网 《药品上市后变更管理办法》
附件:1.药品上市后变更管理办法(试行)
2. 关于实施《药品上市后变更管理办法(试行)》的说明
3. 《药品上市后变更管理办法(试行)》政策解读
4. 药品上市许可持有人变更申报资料要求
国家局政策线上解读会 -【视频回看梳理几点与药企数字化规划
关键词1:融合 - 研发注册数据核查与商业GMP记录检查对照
大侠解读:
1.法规解读 - 监管的每次变更评估药品的全生命周期相互关联快速有效的评估影响范围充足的证据来发起申请或备案
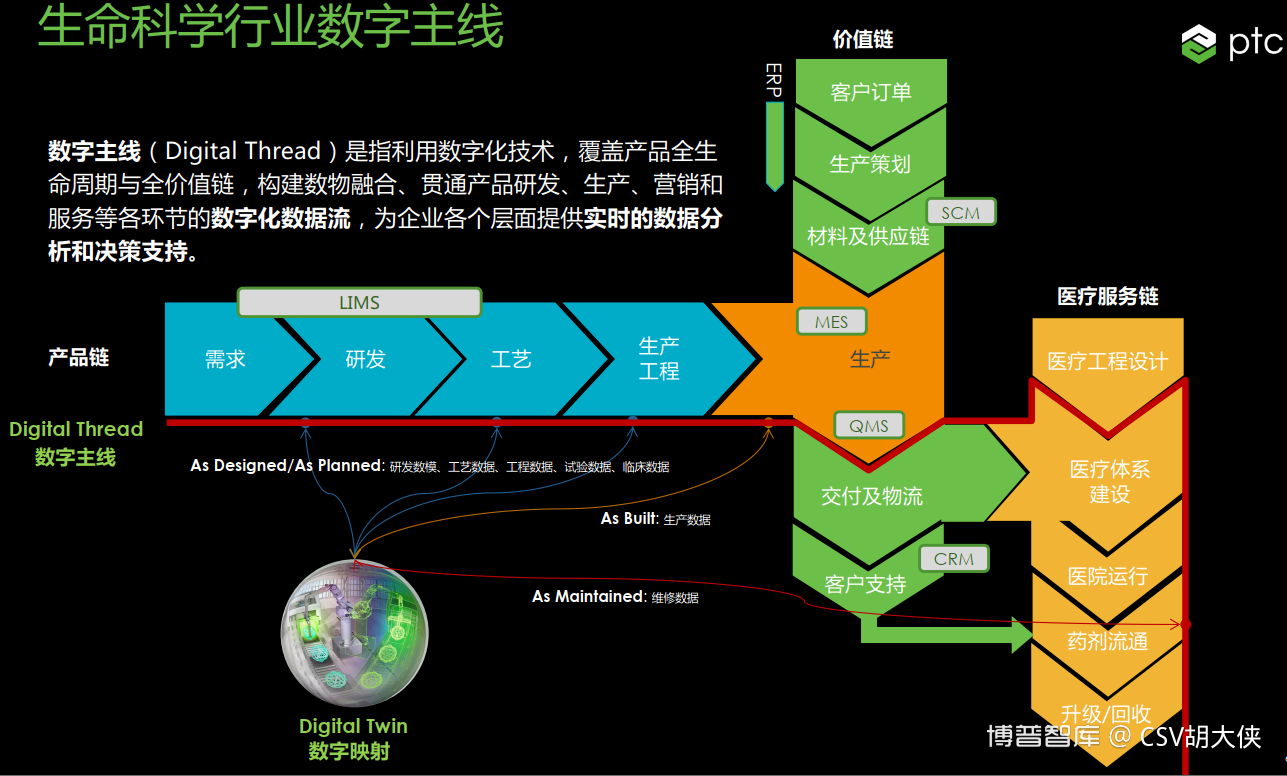
2.解决方法 -若想能正确且快速的评估产品变更影响的范围【从研发到生产到流通】产品全生命周期管理系统PLM纸质文件系统关联性弱,无法自动识别提示变更影响药品注册eCTD等申报已经要求实现特定格式的无纸化申报节省文件格式转化
关键词2:深入 - 品种及产线级管理与注册标准执行情况

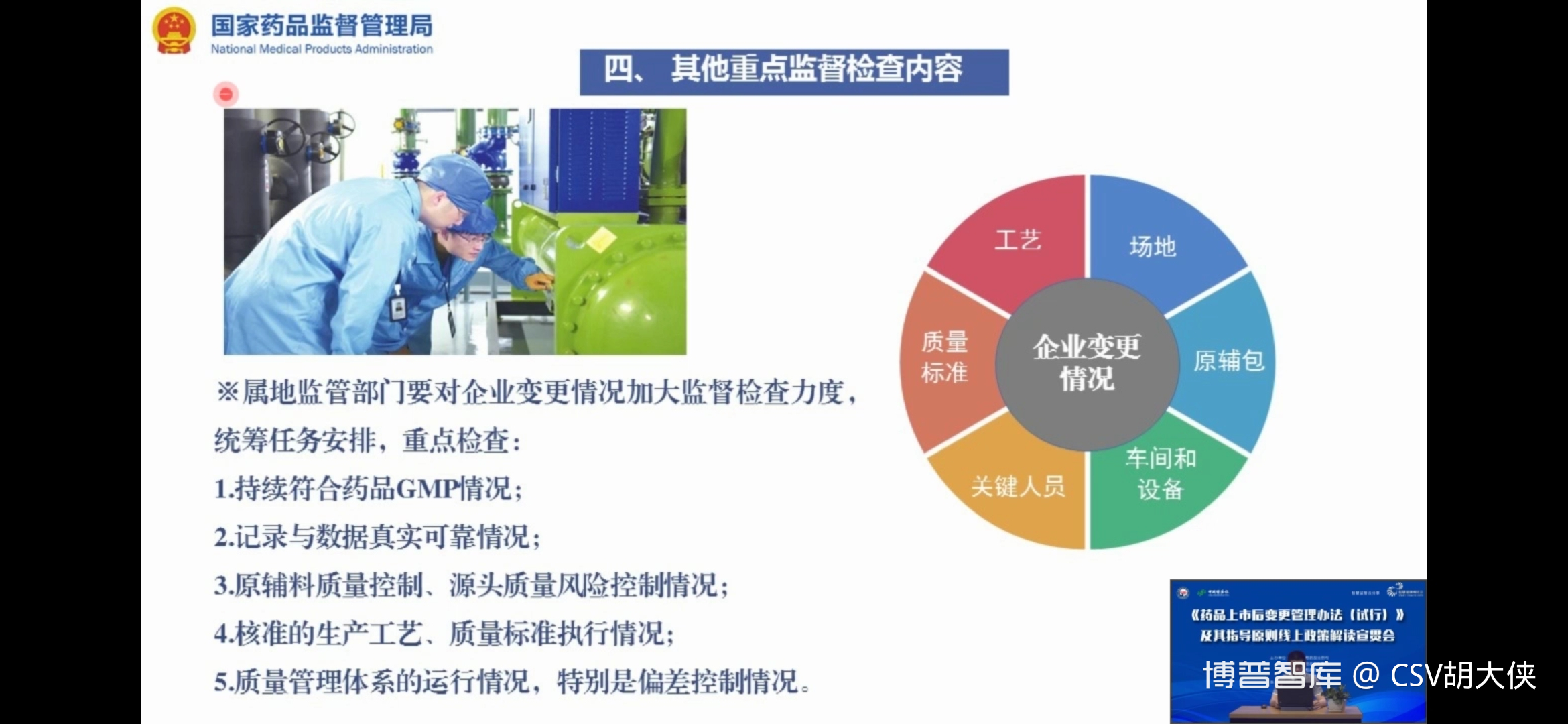
大侠解读
1.法规解读 - 基于新变更管理办法,监管关注点将更加深入和细化 – 产线级的生产工艺生产设备关键参数生产批量
2.解决方法 - “生产工艺生产设备关键参数生产批量ERP/MES/LIMS的上线已经成为刚需主数据功能工单功能日常执行不出现重大偏离
关键词3:信息化 - 药品数据管理的“电子记录时代”已经来临!

大侠解读
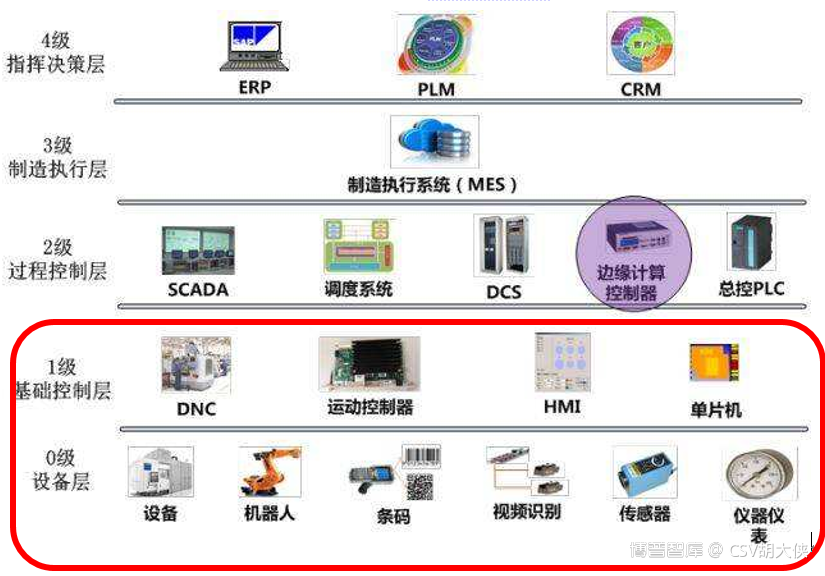
1.法规解读 - 官方宣贯会再次强调了“使用信息化手段电子记录信息化手段生产、检验过程中形成人工操作(包括人工操作、观察及记录等)步骤数据及时录入相关信息化系统或转化为电子数据
2.解决方法 - 参考上述法规和宣贯会要求,对照下图ISA95自动化标准,很显然官方不仅仅希望药企去上Level4和Level3的ERP,MES,LIMS信息化系统来解决生产和检验批记录电子化的问题;而且一定程度上,希望用SCADA,DCS数据接口+PLC探头或Barcode-Scan条码扫描枪的自动化方式去完成全过程的数据采集和录入避免人工录入数据主观筛选数据无意录错数据