这是CSV胡大侠专栏文章第27篇,欢迎大家多多关注支持
CSV胡大侠 -系列文章专栏
CSV胡大侠 -博普视频课传送门
0.前言回顾
在之前文章中,我们讨论了ISPE新指南《Data Integrity By Design》的核心内容其要素构建一个数据治理体系(Data Governance framework)-详情参见链接运用质量风险管理方法(Quality Risk Management)-详情参见链接结合知识管理工具(Knowledge Management) -详情参见链接数据的可用性与保存期(Data Availability & Retention) - 详情参见链接流程的梳理与控制(Business Process Mapping)-详情参见链接
那么在这个基础上,我们就可以系统地来看计算机化系统质量管理系统(Computerized System Quality Management System)
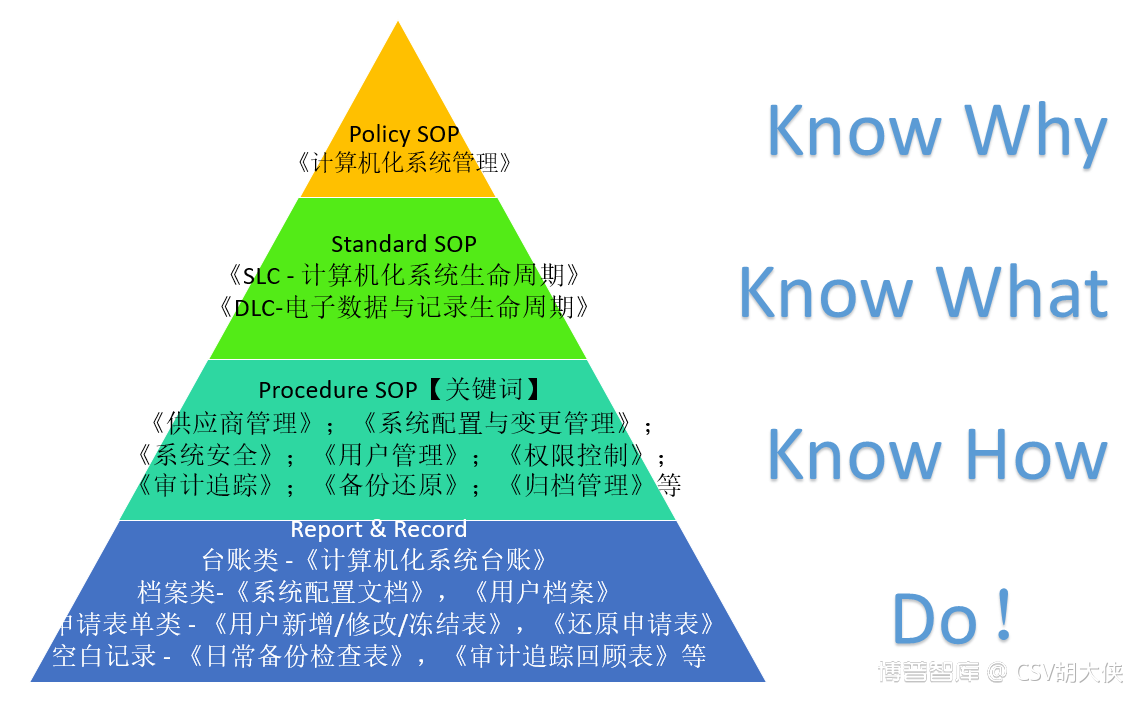
Know Why & Know WhatKnow How & Do
1.重点分析
1.1 CS QMS Policy 原则性文件 - 《计算机化系统管理》;
参考ICH Q10制药质量系统(PQS),其建立质量系统的目标主要是以下三点:Achieve product realization 将药品从研发到生产,最后制造出来Establish and maintain a state of control 使上述过程处于验证受控Facilitate continual improvement 帮助其持续提升!

[i]
所以参考上图,对于质量原则(Quality Policy)层级,计算机化系统需要考虑的:不仅是GxP范围内,计算机化系统自身如何管理;而且需要关联好已有的质量管理体系,比如说:设备验证仪器验证区分和关联不会生搬硬套GAMP5基于风险结合自身已有体系影响性评估USP1058的标准初始风险评估
1.2 CS QMS Standard标准文件 – SLC & DLC 系统生命周期SOP与数据生命周期SOP;
原则规定好之后,对于计算机化系统管理的具体标准则可以参考ISPE指南中的SLC – 计算机化系统生命周期[i][ii]系统生命周期包括系统设计、规范、编程、测试、安装、运行、维护一直到退役[iii][iv]数据全生命周期数据生命周期(DLC - Data Life Cycle)产生、记录、处理、审核、分析、报告、转移、储存、归档、恢复直至失效销毁[v]
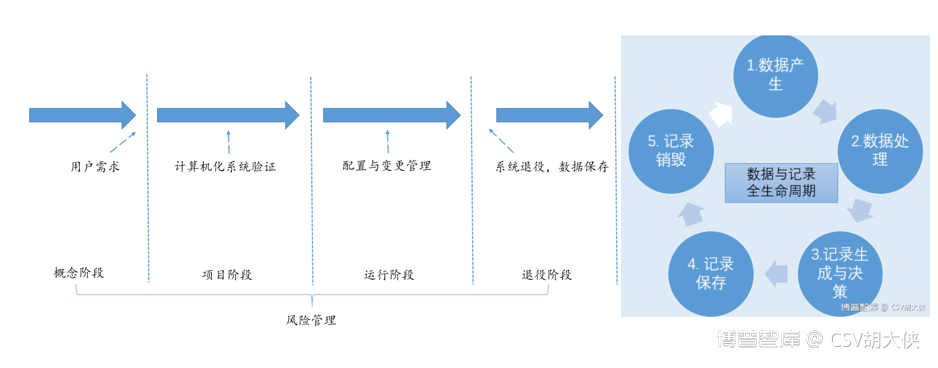
对于SLC – 计算机化系统生命周期,这个方法是让我们从宏观大的角度思考计算机化系统的质量管理问题,比如检查官重点关注审计追踪 Audit Trail功能,从风险管理+SLC系统未来使用及合规的角度来验证系统Quality by Design & Data Integrity By Design(质量源于设计,数据可靠性源于系统设计)
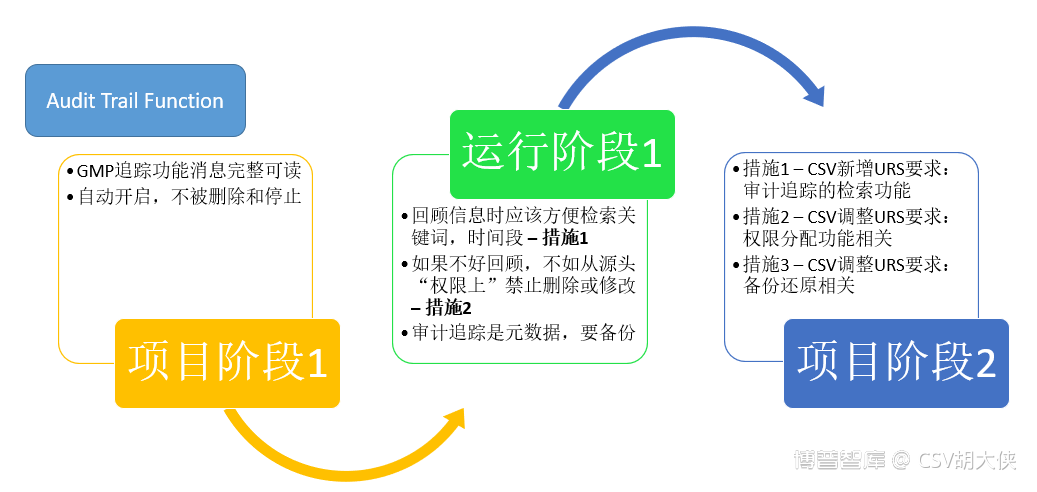
从电信号/电子数据/电子记录分析real backup data
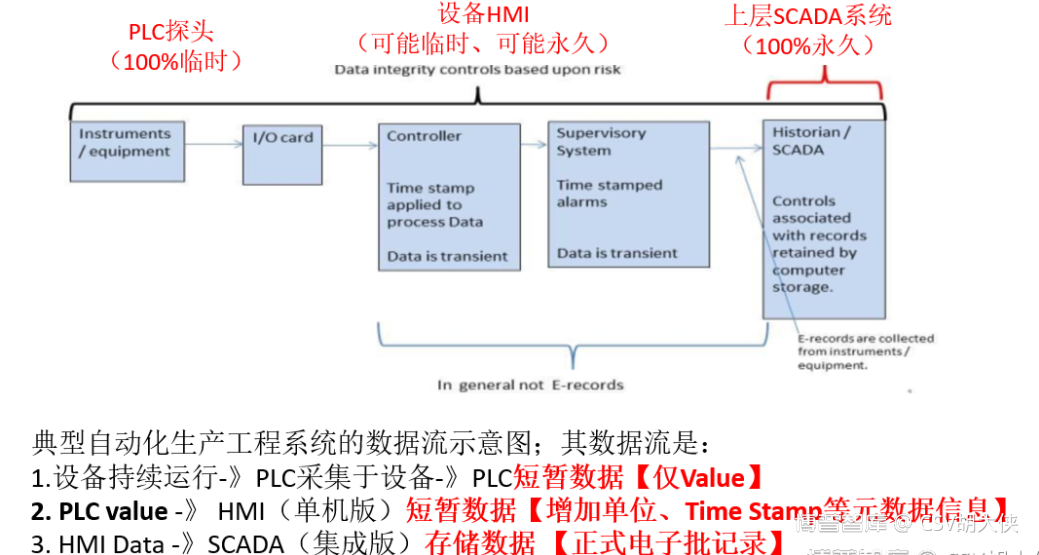
如上图所示,从数据生命周期DLC的角度,从微观角度分析原始数据的产生(Raw Data Creation)电信号是临时数据,所以不需要考虑备份产生的短暂即时的电信号电子数据是临时数据,未被用作正式记录前可以不需要考虑备份,但须需要考虑数据防篡改如果我们能运用DLC这个工具从电信号,电子数据与电子记录的角度不仅能帮助企业通过FDA以及EU GMP的CSV合规检查减少不少日常无意义的备份运维工作
未完待续,敬请期待.....
胡大侠 CSV&DI专栏阅读
10.“DCS 与 SCADA相同与不同” - 《大侠科普Pharm 4.0》系列 1 -链接
9.《“Knowledge Management” - ISPE新指南《数据可靠性源于设计》品鉴3 -链接
8.《“Quality Risk Management” - ISPE新指南《数据可靠性源于设计》品鉴2 -链接
7.《“Foundation of DI by Design”-ISPE新指南《数据可靠性源自设计》品鉴1 -链接
6.《“透明生产即信任!智能制造是未来?” - 参观汤臣倍健智能工厂随笔》-链接
5.《备份是CSV必要功能吗? - 从电信号/电子数据/电子记录分析real backup data》 -链接
4.《SOP无可操作性&权限控制混乱 - CSV检查的重灾区》 -链接
3.《老旧生产系统需补做备份还原测试吗?如何做?》-链接
2. 《CSV的OQ&PQ的相同与不同》-链接
1. 《所有计算机化系统都需要定期备份和定期还原测试吗?》-链接
[i]http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm070336.pdf
[ii]关于SLC 计算机化系统生命周期,出自Chapter 4 Life Cycle Phase, ISPE GAMP5 : A RiskBased Approach to compliant GxP computerized system
[iii]
[iv]
[v]药品数据管理规范(征求意见稿)2018/01/05

