0661 热分析法
热分析法是利用温度和(或)时间关系来准确测量物质理化性质变化的关系,研究物质在受热过程所发生的晶型转变、熔融、蒸发、脱水等物理变化或热分解、氧化等化学变化以及伴随发生的温度能量或重量改变的方法。
物质在加热或冷却过程中,当发生相变或化学反应时,一定伴随着热量的吸收或释放过程;同时根据相律,物相转化时的温度(如熔点、沸点等)保持不变。纯物质(含化学纯度或晶型纯度)具有特定的物相转换温度和相应的热焓变化值(△H)。这些常数可用于物质的定性或定量分析,供试品的实际测定值与这些常数的偏离及其偏离程度又可用于定量检查供试品的纯度。
热分析法可广泛应用于物质的多晶型、物相转化、结晶水、结晶溶剂、热分解以及药物的纯度、相容性与稳定性等研究中。
—、热重法
热重法(TG)是在程序控制温度下,测量物质的重量与温度关系的一种方法。记录的重量变化与温度或时间的关系曲线即热重曲线(TG曲线)。由于物相变化(如失去结晶水、结晶溶剂、转晶或热分解等)时的温度保持不变,所以热重曲线通常呈台阶状,重量基本不变的区段称平台。利用这种特性,可以区分样品中所含的水分是吸附水(或吸附溶剂)还是结晶水(或结晶溶剂),并根据平台之间的失重率可以计算出所含结晶水(或结晶溶剂)的分子比例。
通常,在加热过程中,吸附水(或吸附溶剂)的失去是一个渐进过程,而结晶水(或结晶溶剂)的失去则发生在特定的温度或温度范围(与升温速率有关),在此温度由于失重率发生了突跃而呈台阶状。
热重法可用于某些药物的干燥失重或水分测定。当选择热重法作为供试品中的水分测定方法时,应确保供试品中不含有其他挥发性成分。
检测仪器应根据操作规程,定期使用有证标准物质对温度(高纯铟或锌等)、天平(一水草酸钙等)进行校准,以保证检测结果的准确性。
热重法如与质谱法联用可用于供试品中结晶溶剂(含水)或其他可挥发性成分的定性、定量分析。
二、差热法与差示扫描量热法
在对供试品与热惰性的参比物进行同时加热(或冷却)的条件下,当供试品发生某种物理或化学的变化时,将使热效应改变,供试品和参比物质之间将产生温度差(ΔT)。这种在程序控制温度下,测定供试品与参比物之间温度差与温度(或时间)关系方法称为差热法(DTA)。而测量输给供试品与参比物热量差(dQ/dT)与温度(或时间)关系的方法称差示扫描量热法(DSC)。
差示扫描量热分析仪可分为功率补偿型和热流型。功率补偿型差示扫描量热分析仪可自动调节输给供试品的加热功率,以补偿供试品发生变化时的热效应,从而使供试品与参比物之间的温度始终保持不变(△T=0)。由于△T=0,所以供试品与参比物之间没有附加的热传导。热流型差示扫描量热分析仪是在输给供试品与参比物相同的功率条件下,测定供试品与参比物两者的温度差(△T),通过热流方程将温度差(△T)换算成热量差(dQ/dT)。热流型差示扫描量热分析仪应用较为广泛。差示扫描量热法的定量测定准确度通常好于差热法。
DTA曲线与DSC曲线的形状极为相似,横坐标均为温度T(或时间不同之处仅在于前者的纵坐标为△T而后者为dQ/dT。在两者的曲线上,随供试品不同而显示不同的吸热峰或放热峰。
在差热法或差示扫描量热法应用中,通常可以采用α-氧化铝空坩埚或其他惰性空容器作为参比物。
检测仪器应根据操作规程,定期使用有证标准物质对温度(高纯铟或锌等)进行校准,以保证检测结果的准确性。
差热法与差示扫描量热法可用于下列数据的测量。
1.转换温度
DTA或DSC两种实验方法均客观地记录了物质状态发生变化时的温度。例如熔融曲线可显示熔融发生时的温度(onset值)和峰值温度(peak值)。但这两种温度值与熔点值可能并不一致(如受升温速率等影响)。
2.转换热焓
吸热或放热峰的峰面积正比于相应的热焓变化,即:
M·△H=K·A
式中 M为物质的质量;
△H为单位质量物质的转换热焓;
A为实测的峰面积;
K为仪器常数。
先用已知△H值的标准物质测定仪器常数K后,即可方便地利用上式由实验求取供试品的转换热焓。
当不同供试品的化学成分相同,而差热法或差示扫描量热法获得的测量转换温度值或转换热焰值发生变化时,表明不同供试品的晶型固体物质状态存在差异。
3.纯度
理论上,化学固体纯物质(含化学纯度或晶型纯度)均具有一定的熔点(T0)或无限窄的熔距,并吸收一定的热量(熔融热焓△Hf。任何熔距的展宽或熔点下降都意味着物质化学纯度或晶型纯度的下降。杂质所引起的熔点下降可由范特霍夫方程表示。
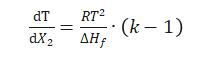
式中 T为热力学温度,K;
X2为杂质的浓度(摩尔分数);
△Hf为纯物质的摩尔熔融热焓;
R为气体常数;
k为熔融时杂质在固相与液相中的分配系数。
假定熔融时无固溶体形成,即k=0,此时可对式(1)积分,得:
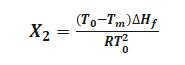
式中 T0为纯物质的熔点,K;
Tm为供试品的实测熔点,K。
由实验测得△Hf、T0和Tm后,代入式(2)即可求得供试品中杂质的含量。
无定型态固体物质(或非晶态物质)可能没有明确的熔点(T0)或呈现宽熔距现象,其熔距宽度与物质的化学纯度或晶型纯度无关。无定型固体物质状态亦不符合范特霍夫方程规律。
4.晶型与共晶
固体化学物质由于分子排列规律变化,可形成两种或两种以上的固体物质状态,被称为多晶型现象。不同晶型物质的DTA曲线、DSC曲线可以存在差异。由两种或两种以上的化学物质共同形成的晶态物质被称为共晶物。共晶物(通常为单吸热峰)与物理混合物(吸热峰数量通常与物理混合物中物质成分组成数量相关)的DTA曲线、DSC曲线存在差异。
三、热载台显微镜法
热载台显微镜法可观测供试品的物相变化过程,通过光学显微镜或偏光显微镜直接观测并记录程序温度控制下供试品变化情况。
热载台显微镜法的观察结果比较热重法、差热法、差示扫描量热法给予了更直观的物相变化信息。热载台显微镜法的温度控制部分需要进行校准。
四、测定法
热重法、差热法、差示扫描量热法、热载台显微镜法等各种检测方法,均应按各仪器说明书操作。为了尽可能得到客观、准确、能够重现的热分析曲线或相变规律,首先应在室温至比分解温度(或熔点)高10~20℃的宽范围内做快速升温或降温速率(每分钟10~20℃)的预试验,然后在较窄的温度范围内,以较低的升温或降温速率(必要时可降至每分钟1℃或更少)进行精密的重复试验,以获得准确的热分析结果。
热分析报告应附测定条件,包括仪器型号、温度的校正值、供试品的取用量和制备方法、环境气体、温度变化的方向和速率,以及仪器的灵敏度等。
需要指出,利用范特霍夫方程测定纯度时,是建立在杂质不形成固溶体的假设之上的,所以本法的应用具有一定的局限性,特别是当供试品纯度低于98%、或为混晶物质(即不同晶型的混合物熔点值无差异)、或熔融时分解的物质时,则难以准确地测定物质的化学纯度或晶型纯度。
继续阅读
在线查询结果来源于2020年版中国药典,仅供参考。由专业团队进行审核校对。

