一、药品板块
1、指导原则征求意见
1.1.《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》
1.1.1.阿片类药物是缓解中度至重度疼痛药物的重要组成部分。
1.1.2.:药物滥用是指蓄意、非医疗目的地使用(即使只有一次)具有依赖特性的药物,以达到预期的精神或生理效果。
1.1.3.滥用方式:粉碎或咀嚼后服用、粉碎后鼻吸、粉碎后抽吸、粉碎溶解后注射等。
1.1.4.适用范围:则适用于采用单独或联合使用物理/化学屏障、激动剂/拮抗剂组合和厌恶剂等防滥用技术的阿片类口服固体仿制药。
1.1.5.友情提示:具有防滥用特性的阿片类药物属于复杂仿制药,本指导原则重点关注体外药学研究与评价,如申请人在完成体外研究后经自我评估,认为仅完成药学研究尚不充分时,可与审评机构沟通,讨论是否需进行体内研究。
1.1.6.常见防滥用技术:物理/化学屏障、激动剂/拮抗剂组合、厌恶剂、其他
1.1.7.仿制药与参比制剂进行防滥用特性对比评估基本原则:
1.1.8.防滥用特性评估:
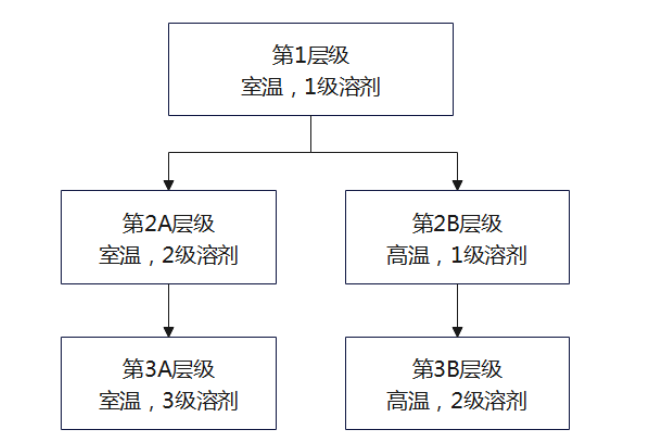


1.1.9.目标防滥用特性评估
1.1.10.可提取性评估决策树(每个虚线框代表一个层级)

鼻吸滥用途径药学研究决策树
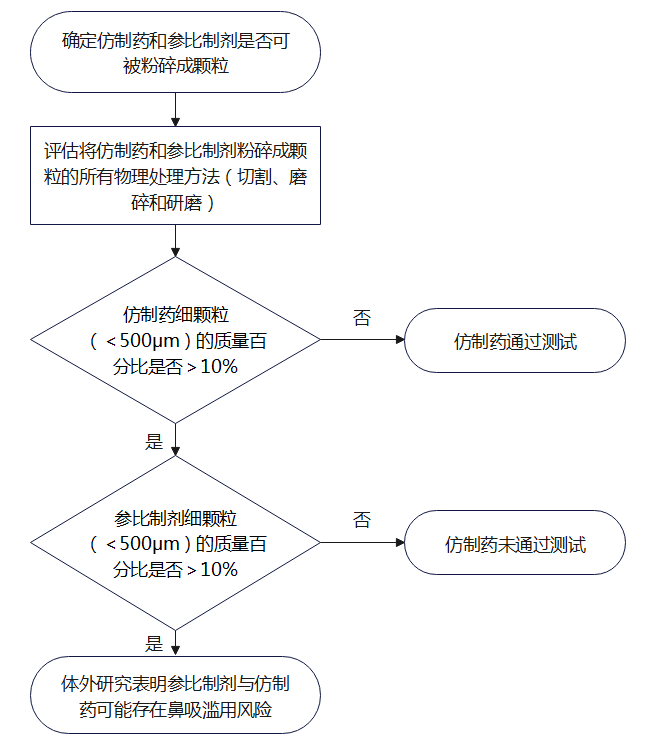
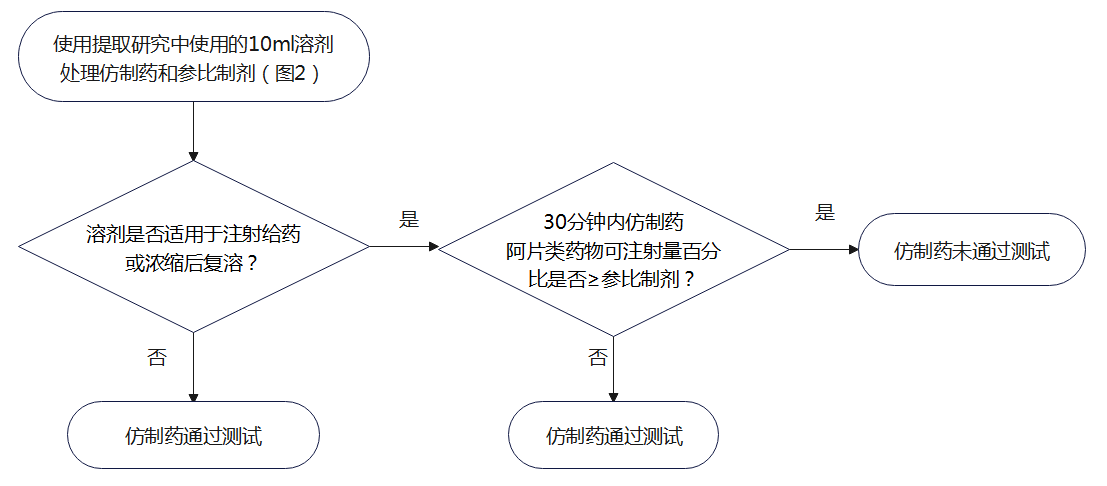
注射滥用途径防滥用特性评估的药学研究决策树
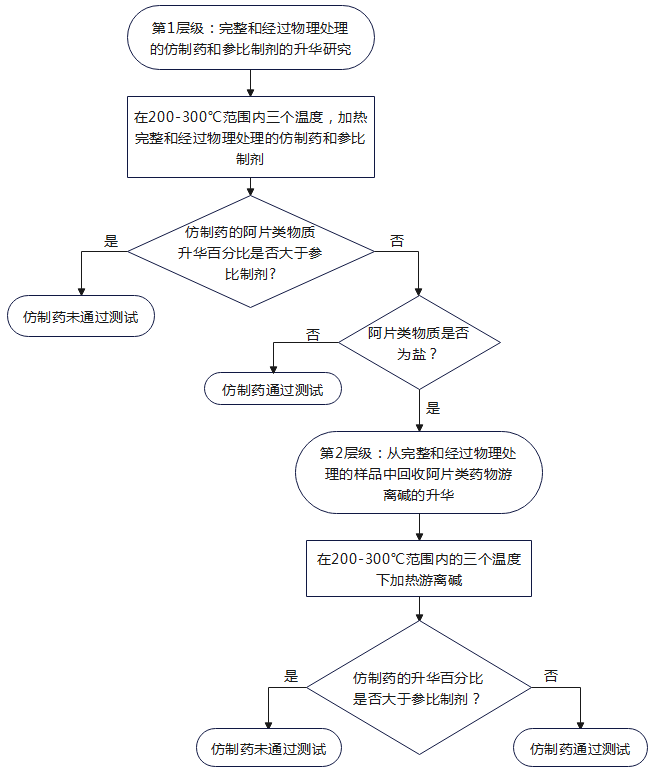
抽吸滥用途径防滥用特性评估的药学研究决策树
1.2.《复方药物临床试验技术指导原则(征求意见稿)》
定义:复方药物是指含有两种或两种以上已知活性成份的药物。
本指导原则主要适用于化学药品,其一般原则也适用于治疗用生物制品。在体内分解为两种或以上活性成份的药物研发也可参考本指导原则。本指导原则不适用于中药复方药物以及由维生素、微量元素和矿物质组成的复方药物。
本指导原则主要分为五个章节和参考文献,五章节分别为背景和目的、适用范围、组方合理性的整体考虑、临床证据的整体考虑、临床试验设计的考虑。主要内容包括:
第一节背景和目的:主要阐述了复方药物的定义、其明显临床优势的解析,以及制定本指导原则的目的。
第二节适用范围:主要阐述了本指导原则的适用范围。本指导原则主要适用于化学药品,其一般原则也适用于治疗用生物制品。在体内分解为两种或以上活性成份的药物也可参考本指导原则。
第三节组方合理性的整体考虑:主要阐述评估复方药物组方合理性的考虑要点。通常,组成复方药物的单药为已知活性成份,应有充分的临床试验数据证实各单药的有效性和安全性,且各单药应是相同作用机制药物中基于临床试验和/或临床实践应用中广泛确认的主流药物。各活性成份对疗效和/或安全性均具有一定的贡献。论证组方合理性应从各单药的作用机制、药物相互作用、给药方案等方面综合考虑。并说明了不鼓励开发的具体情形。
第四节临床证据的整体考虑:主要阐述复方药物申报上市时需提供的整体临床证据,包括:复方药物的临床试验和/或联合用药的临床试验、或临床试验结合文献数据等。提供的数据需证明复方药物中各活性成份对疗效和/或安全性的贡献、以及确证复方药物治疗相对于单药治疗的明显临床优势。
第五节临床试验设计的考虑:复方药物临床试验的设计取决于复方的立题和治疗目标。针对用于加载治疗、初始治疗的不同类型复方,分别阐述了临床试验设计的具体考虑和重点关注内容。针对用于初始治疗适应症的复方药物中各活性成份都具有疗效的情形,确证性临床试验通常需要证明复方药物在预先设定时间点上的临床结局具有优效性,且安全性特征可接受。
1.3.ICH《Q3D(R2):元素杂质指导原则》征求意见
申请人需在现行药学研究技术要求基础上,按照Q3D(R2)指导原则的要求开展研究;本公告发布之日起6个月后开始的相关研究(以试验记录时间点为准),均适用Q3D(R2)指导原则,Q3D(R1)指导原则同时废止。
Q3D (R2)文件历史

药品中的元素杂质有多种来源;它们可能是在合成中有意添加的催化剂的残留,也可能是实际存在的杂质(如:与生产设备或包装系统相互作用产生的杂质或药品各个组分中存在的杂质)。因为元素杂质不能为患者提供任何治疗作用,所以它们在药品中的含量需要被控制在可接受的限度范围内。
本指导原则分为三个部分:评估潜在元素杂质的毒性数据;确定每一种有毒元素的每日允许暴露量(PDE);以及运用基于风险的方法控制药品中的元素杂质。只要药品中的元素杂质没有超过 PDE,申请人就不必根据生产能力收紧其限度。
本指导原则确定的PDE 值可以保证所有患者人群的公众健康。有时元素杂质在低于毒性阈值的情况下可能会影响药品的其他质量属性(如:对原料药降解有催化作用的元素),在这种情况下需要保证将元素杂质控制在一个更低的水平。另外,对于具有较高PDE 值的元素,可能需要从药品质量的角度出发考虑其他限度并参考其他指导原则(如:ICH Q3A)。
本指导原则给出一个采用 ICH Q9 中所述的风险管理原则来评估和控制药品中元素杂质的方法。该方法为开发基于风险的药品中元素杂质的控制策略提供了平台。
本指导原则适用于新制剂(定义见 ICH Q6A 和 Q6B)以及含已有原料药的新制剂。
本指导原则的适用范围包括纯化蛋白质和多肽(含重组或非重组来源的蛋白质和多肽)及其衍生物,以及以它们作为组分的药品(如:偶联物),还包括含化学合成多肽、多聚核苷酸、寡糖的药品。
本指导原则不适用于植物药、放射性药物、疫苗、细胞代谢产物、DNA 产品、过敏原提取物、细胞、全血、血细胞成份或包括血浆及血浆衍生物在内的血液衍生物、非体循环透析液、以及为了治疗作用而特意添加到药品中的元素。
本指导原则也不适用于基于基因(基因治疗)、细胞(细胞治疗)和组织(组织工程)的药品。在某些地区,这些药品被称为先进治疗药品。
本指导原则不适用于在临床研究阶段使用的药品。随着商业开发的进程,可以采用本指导原则的原理来评估新药中可能存在的元素杂质。
ICH 颁布本指导原则 36 个月内,已上市药品无需实施 Q3D。
1.4.《化药口服固体制剂连续制造技术指导原则(征求意见稿)》
本指导原则主要内容包括:概述、总体考虑、相关概念、控制策略、工艺验证、稳定性研究、批量变更、药品质量体系、申报资料要求、参考文献共十部分。
本指导原则的起草,借鉴了国外相关指导原则及标准,阐明了化药口服固体制剂连续制造的基本考虑,相关要求与ICH Q13 的基本原则和理念保持一致。申请人在研究过程中,可一并参照 ICH Q13 及其他相关指导原则,加强对连续制造相关概念的理解,基于科学的研究方法,建立有效的连续制造的控制策略。
本指导原则适用于化药口服固体制剂的连续制造。
本指导原则所述的连续制造工艺通常适用于两个或两个以上固体单元操作直接相连组成的整合工艺。
2、通知公告
2.1.标准物质参考说明书公示
2022年9月5日,中检院已完成EB病毒衣壳抗原IgM抗体国家参考品和EB病毒衣壳抗原IgG抗体国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年9月10日前将意见反馈至中检院诊断试剂所。
2.2.药包材标准调研通知
2022年9月6日,国家药典委员会委托有关单位牵头起草《中国药典》塑料类药包材通用技术要求,现拟对部分产品的材料、工艺、检验检测等信息进行调研,以便结合调研情况开展标准制订工作。请相关单位按要求填写调研表,并于2022年10月15日前,将调研表WORD版和盖章后的扫描件电子版一并以电子邮件的方式反馈至联系人。
同时,为增强药包材标准研究用样品的代表性,补充征集部分研究用样。请相关单位配合提供符合要求的样品及有关资料,并于2022年10月15日前邮寄或直接送至“样品寄送地址”。
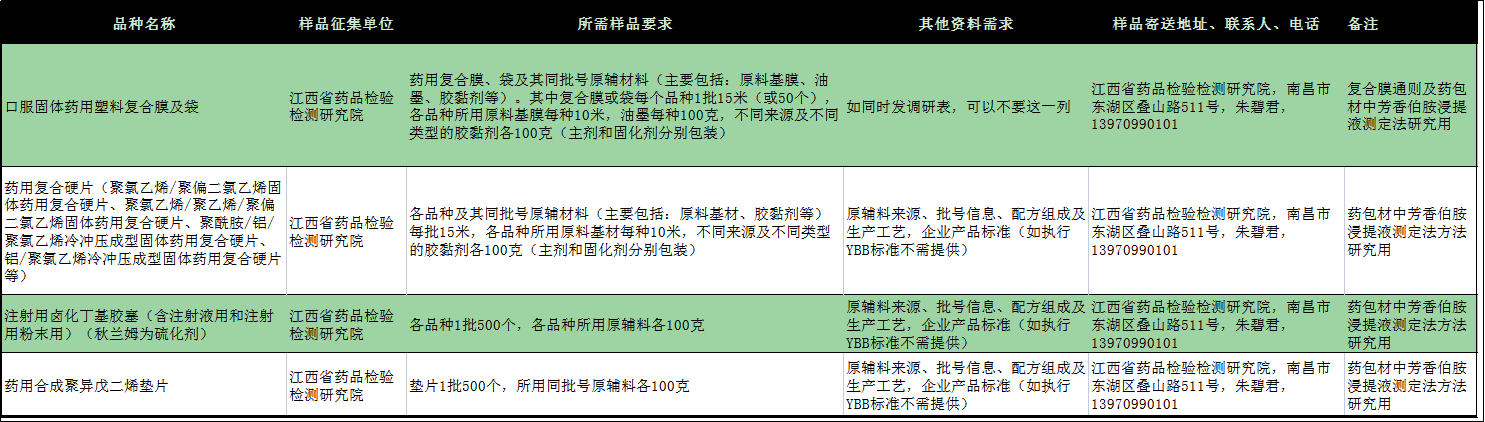
药典委鼓励相关企业积极参与调研以及后续标准制定研讨工作,为科学制定药包材标准提供技术支撑。
2.3.参与推进“绿色环保”药用辅料标准单位名单公示
2022年9月6日,药典委发布共收到十余家单位近百条反馈意见,包括替换有毒有害试剂、优化实验操作步骤等。上述名单特此公布,以示感谢和鼓励!针对“绿色环保”药用辅料标准的反馈意见,药典委已组织有关单位和专家进行系统梳理和逐一分析,后续将分批及时公布解决方案。
积极宣传“绿色环保”药用辅料标准的单位名单(排名不分先后)
提供“绿色环保”药用辅料标准建议的单位名单(排名不分先后)
2.4.国家药监局关于鼓励企业和社会第三方参与中药标准制定修订工作有关事项的公告
2022年9月6日,为进一步提升中药标准管理能力,建立最严谨的标准,优化标准工作机制,全面构建政府引导、企业为主、社会参与、开放融合的中药标准工作新格局,充分发挥社会力量在标准工作中的重要作用,国家局鼓励企业和社会第三方参与中药标准制定修订工作。
本公告所称中药标准是指国务院药品监督管理部门颁布的中药标准,以及各省、自治区、直辖市人民政府药品监督管理部门依法颁布的中药材标准、中药饮片炮制规范和中药配方颗粒质量标准。
对于经国务院药品监督管理部门核准的中药注册标准,对其完善的主体责任由药品上市许可持有人或中药生产企业履行。
2.5.国家药监局关于修订羟乙基淀粉类注射剂说明书的公告
2022年9月6日,国家局根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对羟乙基淀粉类注射剂(包括羟乙基淀粉20氯化钠注射液、羟乙基淀粉40氯化钠注射液、高渗氯化钠羟乙基淀粉40注射液、羟乙基淀粉200/0.5氯化钠注射液、高渗羟乙基淀粉200/0.5氯化钠注射液、羟乙基淀粉130/0.4氯化钠注射液、羟乙基淀粉130/0.4电解质注射液)说明书内容进行统一修订。
上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照羟乙基淀粉类注射剂说明书修订要求(见附件),于2022年12月2日前报国家药品监督管理局药品审评中心或省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
2.6.关于勘误百合(卷丹)配方颗粒国家药品标准有关内容的函
2022年9月7日,药典委发布“百合(卷丹)配方颗粒”国家标准,标准号为YBZ-PFKL-2021007,已于2021年11月1日正式执行,经核查,对其标准在【特征图谱】、【含量测定】项中6处对照品“王百合苷B”名称进行勘误,应为“2-乙酰王百合苷A”。
2.7.关于勘误蜜百合(卷丹)配方颗粒国家药品标准有关内容的函
2022年9月7日,药典委发布“蜜百合(卷丹)配方颗粒”国家标准,标准号为YBZ-PFKL-2021089,已于2021年11月1日正式执行,经我委核查,对其标准在【特征图谱】、【含量测定】项中6处对照品“王百合苷B”名称进行勘误,应为“2-乙酰王百合苷A”。
二、器械板块
2022年9月5日,食品药品审核查验中心发布举办医疗器械生产企业质量体系实务培训班的通知,培训时间为9月26日至29日。

