一、药品板块
1.《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则(征求意见稿)》
生理药代动力学模型目前在儿科人群药物研发方面应用广泛,为了合理规范使用该模型,药品审评中心组织起草了《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则(征求意见稿)》。
该指导原则包括概述、总体考虑、研发应用、模型实施与评价、格式与提交、讨论和参考文献共计七项内容,其和核心内容为模型实施与评价,该章节主要内容如下:
数据来源:
建模:
验证及应用:
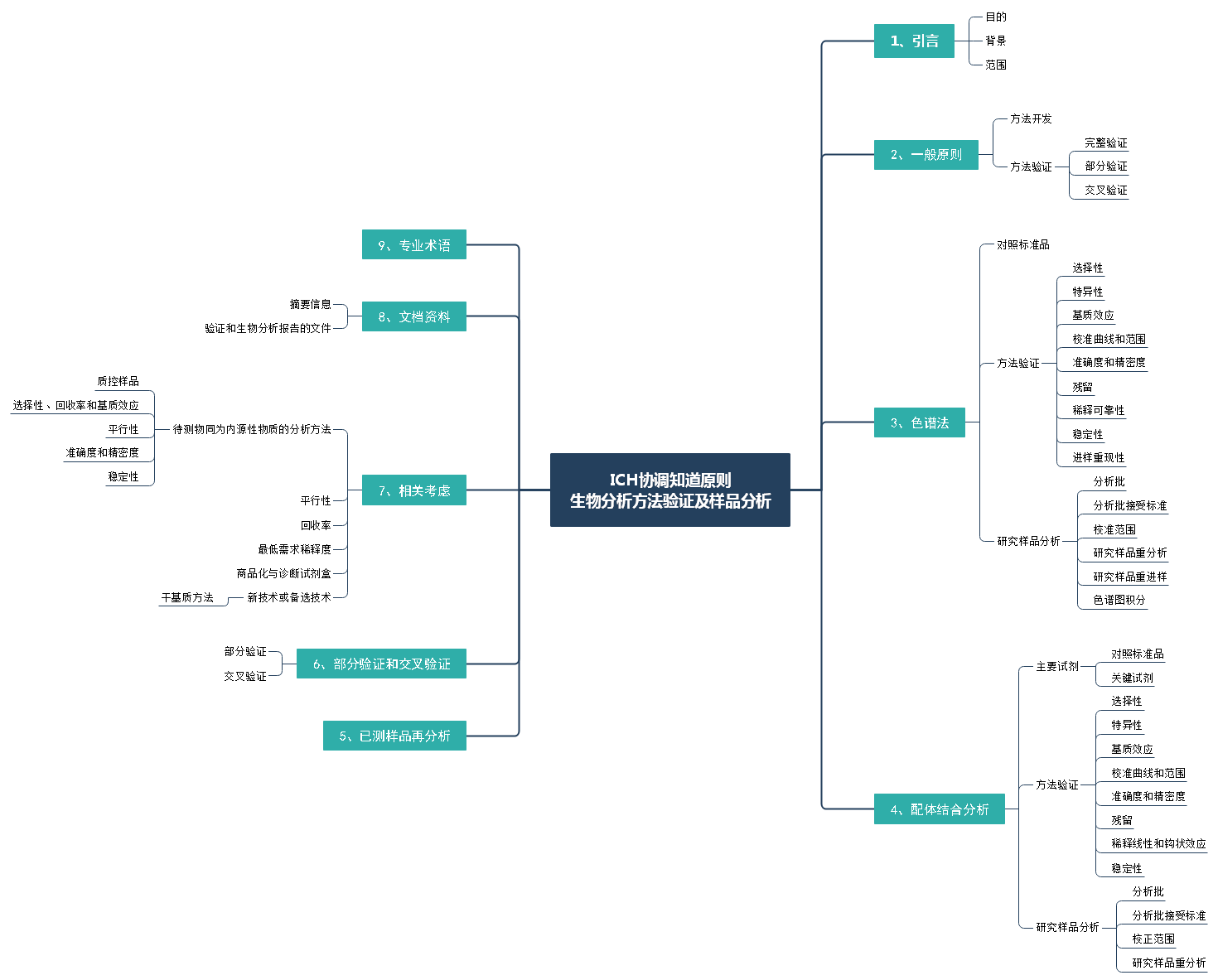
2.征求ICH《M10:生物分析方法验证及样品分析》指导原则实施建议和中文版的通知
为推动ICH三级指导原则在国内的平稳落地实施,药审中心拟定了《M10:生物分析方法验证及样品分析》实施建议,同时组织翻译中文版。现对M10实施建议和中文版公开征求意见,为期1个月。
该指导原则主要内容包括引言、一般原则、色谱法、研究样品分析、配体结合分析、已测样品再分析、部分验证和交叉验证、相关考虑、文档资料和专业术语9部分内容。
主要内容如下图:
3.《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,药审中心组织起草了《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》,现公开征求意见。
该指导原则主要内容如下:
其他相关指导原则:
4.征求《呼吸道合胞病毒感染药物临床试验技术指导原则》意见
呼吸道合胞病毒是世界范围内引起5岁以下儿童急性下呼吸道感染最常见的病毒病原,是造成婴幼儿病毒性呼吸道感染住院的首要因素。国内多家制药企业已开始呼吸道合胞病毒感染药物的研发。目前国内外尚参考的指导原则,为进一步明确技术标准,提高企业研发效率。药审中心起草了《呼吸道合胞病毒感染药物临床试验技术指导原则》,经中心内部讨论,已形成征求意见稿。
该指导原则主体部分为六个章节:
二、器械板块
1.新产品上市
2022年8月15日,国家药品监督管理局发布批准了北京博辉瑞进生物科技有限公司生产的创新产品“吻合口加固修补片”注册。
吻合口加固修补片共包含管状型、平片型、圆型。管状型和圆型由修补片、背衬、牵引线三部分构成,平片型只有修补片。修补片由脱细胞猪小肠粘膜下层材料制备而成,与背衬用牵引线进行缝合固定。平片型无背衬和牵引线。
该产品是可降解吻合口加固产品,其采用的生产工艺实现了去除动物组织免疫原性的同时,保留天然细胞外基质的结构和生物活性;其结构设计使产品能配套连接各种型号吻合器并提高手术安全性。该产品配合吻合器用于吻合部位的加固,适用于远端胃切除术、近端胃切除术、袖状胃切除术、胃肠吻合术,能够降低胃肠切除手术术后发生吻合口漏、出血等相关并发症,为患者带来受益。
2.通知与公告
2022年8月15日,国家药监局发布关于批准人类辅助生殖技术用医疗器械标准化技术归口单位换届的公告
2022年8月18日,国家药品监督管理局发布7月共批准注册医疗器械产品197个。其中,境内第三类医疗器械产品152个,进口第三类医疗器械产品20个,进口第二类医疗器械产品22个,港澳台医疗器械产品3个。
2022年8月19日,药品评价中心发布由中国医疗器械行业协会主办,国家药品监督管理局药品评价中心支持的第六届中国医疗器械警戒大会定于2022年9月26日-27日在浙江省绍兴市举办。

