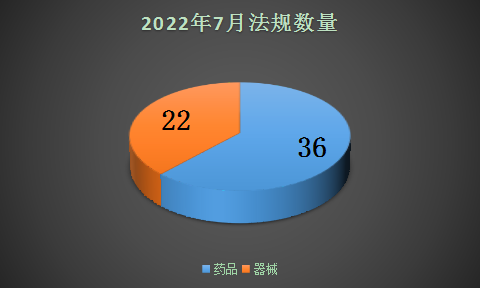
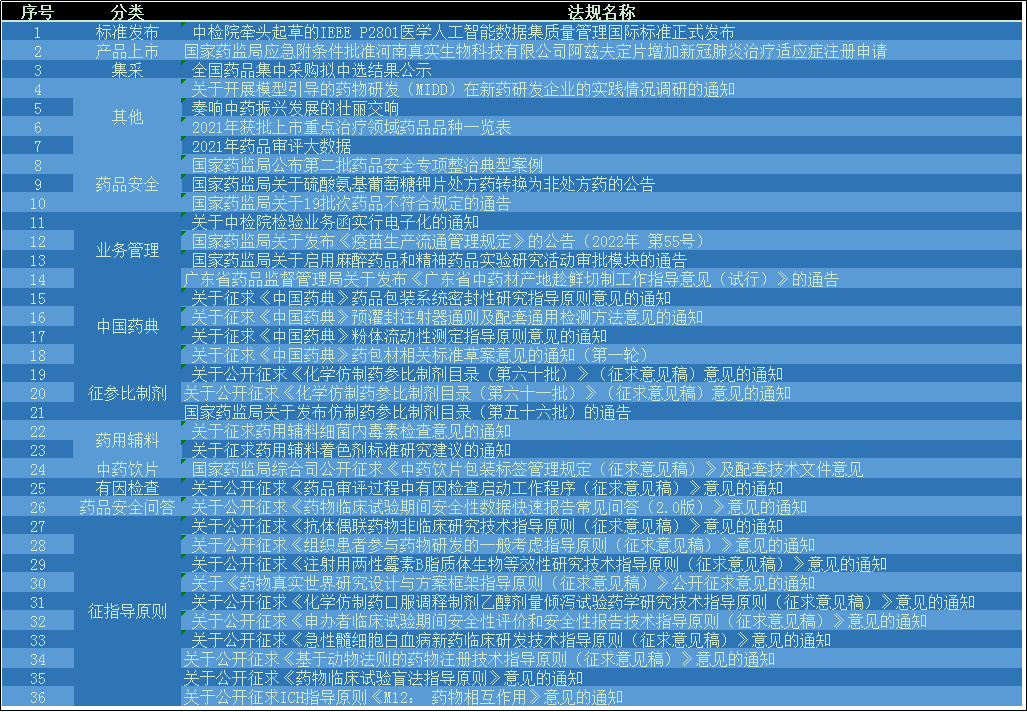
- 本月药品法规方面,征求意见占据药品法规的半壁江山,主要征求意见包括:《中国药典》、仿制药参比制剂、药用辅料、饮片包装管理、有因检查工作程序、药品安全问答、指导原则七项内容。
- 其他法规方面包括:药品安全、处转非、业务管理、标准发布、集采信息公示等内容。
- 2022年7月11日,按照《“十四五”国家药品安全及促进高质量发展规划》和《中国药典》2025年版编制大纲的规划,药典委组织有关单位及专家拟定了《中国药典》药包材标准体系及相应标准草案,主要包含以下内容:
- 药品包装系统密封性研究指导原则;
- 4个预灌封注射器通则:5510 预灌封注射器通则、5511 预灌封注射器用玻璃套筒通则、5512 预灌封注射器用塑料套筒通则、5513 预灌封注射器用不锈钢针通则
- 13个配套通用检测方法:4040 预灌封注射器鲁尔圆锥接头检查法、4041 预灌封注射器护帽密封性检查法、4042 预灌封注射器护帽拔出力测定法、4043 预灌封注射器活塞密合性能检查法、4044 预灌封注射器鲁尔锁定刚性锥头护帽旋开扭矩测定法、4045 预灌封注射器适配器卡圈抗扭力测定法、4046 预灌封注射器适配器卡圈拔出力测定法、4204 药包材溶出物测定法、4206 药包材不溶性微粒测定法、4209 药包材环氧乙烷测定法通则、4226 预灌封注射器钨溶出量测定法、4227 预灌封注射器硅油量测定法。
- 2022年7月18日,药典委发布了首批标准草案第一轮征求意见,征求意见统一截止2022年9月1日。
- 2022年7月5日:根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),药品审评中心组织遴选了第六十批参比制剂。
- 2022年7月27日:根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),药品审评中心组织遴选了第六十一批参比制剂。
- 2022年7月22日:国家局发布第五十六批参比制剂目录。
- 2022年7月6日,药典委联合中国食品药品检定研究院相关部门,拟对药用辅料重点品种的细菌内毒素检查项进行系统研究,并拟定合理规范的细菌内毒素检查项,以加强药品的安全性和质量可控性。重点品种包括但不局限于:制剂中用量大的品种、非水溶性样品、细菌内毒素检查限值制定有疑问的品种、细菌内毒素检查存在一定困难的品种等,不局限《中国药典》已收载品种。
- 2022年7月11日,药典委联合上海市食品药品检验研究院相关部门,拟对药用辅料着色剂重点品种的标准进行系统研究,以加强药品的安全性和质量可控性。重点品种包括但不局限于:儿童用药使用的着色剂、药品中应用广泛的品种、现有标准质控项目不完善或操作性欠佳的品种、现有标准不能满足药用要求的品种,不局限《中国药典》已收载品种。
- 2022年7月8日,国家发布了《中药饮片包装标签管理规定(征求意见稿)》及其配套技术文件《中药饮片标签内容撰写指导原则(征求意见稿)》《中药饮片保质期研究确定技术指导原则(征求意见稿)》。
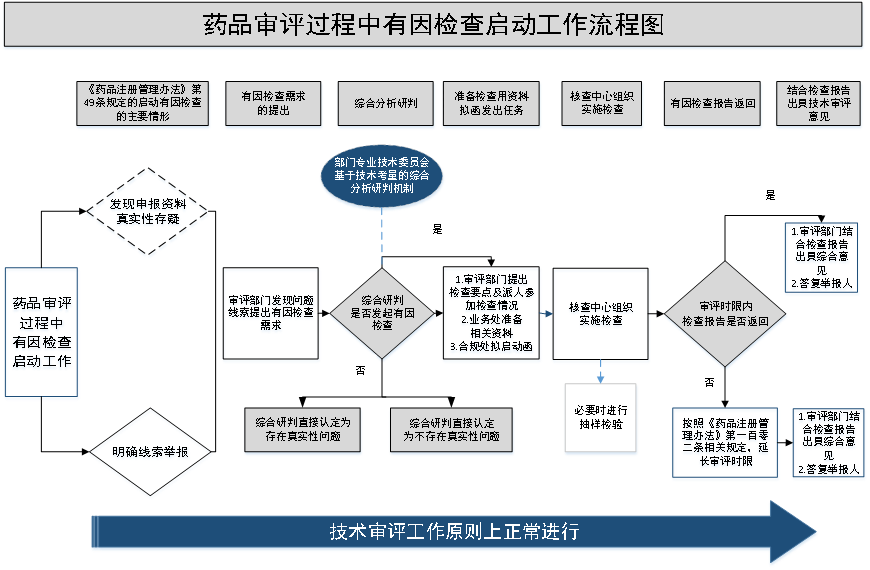
- 2022年7月7日,药品审评中心组织起草了《药品审评过程中有因检查启动工作程序(征求意见稿)》。
- 2022年7月20日,药审中心发布了《药物临床试验期间安全性数据快速报告常见问答(2.0版)》,该问答共包含34个问题,详细内容值得有相关工作的小伙伴仔细阅读。
- 2022年7月6日:《抗体偶联药物非临床研究技术指导原则(征求意见稿)》、《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》
- 2022年7月7日:《注射用两性霉素B脂质体生物等效性研究技术指导原则(征求意见稿)》、《药物真实世界研究设计与方案框架指导原则(征求意见稿)》、《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则(征求意见稿)》
- 2022年7月13日:《申办者临床试验期间安全性评价和安全性报告技术指导原则(征求意见稿)》
- 2022年7月19日:《急性髓细胞白血病新药临床研发技术指导原则(征求意见稿)》
- 2022年7月22日:《基于动物法则的药物注册技术指导原则(征求意见稿)》
- 2022年7月25日:《药物临床试验盲法指导原则(征求意见稿)》
- 2022年7月29日:征求ICH指导原则《M12: 药物相互作用》
- 2022年7月5日:国家药监局公布8个第二批药品安全专项整治典型案例。
- 2022年7月14日:国家局公布湖北省药品监督检验研究院等10家药品检验机构检验,标示为瑞阳制药股份有限公司等16家企业生产的乙酰半胱氨酸注射液等19批次药品不符合规定。
- 2022年7月11日:国家药品监督管理局发布硫酸氨基葡萄糖钾片由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。持有人事项:修订相关说明书、标签进行备案。
- 2022年7月4日:关于中检院检验业务函实行电子化的通知
- 2022年7月8日:国家药监局关于发布《疫苗生产流通管理规定》的公告(2022年 第55号)
- 2022年7月14日:国家药监局关于启用麻醉药品和精神药品实验研究活动审批模块的通告
- 2022年7月29日:广东省为加强本省中药生产企业自建和采购产地趁鲜切制中药材管理,广东省药品监督管理局制定了《广东省中药材产地趁鲜切制工作指导意见(试行)》。
- 2022年7月4日:中检院牵头起草的IEEE P2801医学人工智能数据集质量管理国际标准正式发布
- 2022年7月23日:全国药品集中采购拟中选结果公示
- 2022年7月6日:药品审评中心发布关于开展模型引导的药物研发(MIDD)在新药研发企业的实践情况调研的通知 。
- 2022年7月15日:国家局发布“奏响中药振兴发展的壮丽交响”相关文章,中医药是中华文明传承数千年的瑰宝,正迎来天时、地利、人和的发展时机。作为中医药事业发展的重要基石,中药传承创新发展离不开科学监管护航。
- 2022年7月19日: 国家局公布2021年获批上市重点治疗领域药品品种一览表 、2021年药品审评大数据 。
- 2022年7月25日:国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。本品是我国自主研发的口服小分子新冠病毒肺炎治疗药物。2021年7月20日,国家药监局已附条件批准本品与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。此次为附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者。患者应在医师指导下严格按说明书用药。国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
本月器械法规内容主要包括:征求意见、产品上市、器械安全检查、标准变动。
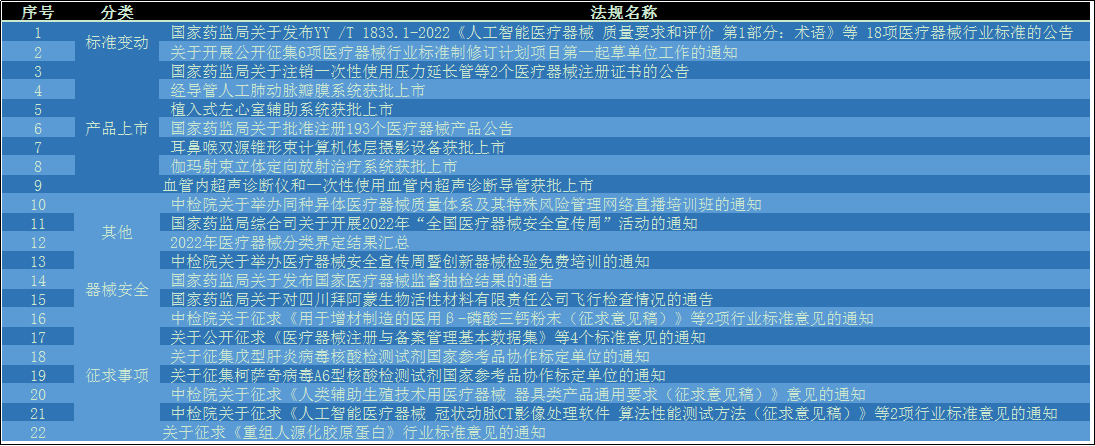
- 2022年7月1日:国家局公开征求《医疗器械注册与备案管理基本数据集》《体外诊断试剂注册与备案管理基本数据集》《医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)》《医疗器械(含体外诊断试剂)监管信息基础数据元值域代码(注册和备案部分)》4个标准意见的通知。
- 2022年7月4日:中检院拟开展戊型肝炎病毒核酸检测试剂国家参考品首批研制工作,现邀请各相关单位进行协作标定。希望有上述已注册产品,或正进行产品研发,且拟申报注册的企业积极参与,配合国家参考品标定的工作。
- 2022年7月7日:中检院拟开展柯萨奇病毒A6型核酸检测试剂国家参考品的首批研制工作,现邀请各相关单位进行协作标定。希望有上述已注册产品,或正进行产品研发、且拟申报注册的企业积极参与,配合国家参考品的标定工作。
- 2022年7月7日:中检院关于征求《人类辅助生殖技术用医疗器械 器具类产品通用要求(征求意见稿)》意见的通知
- 2022年7月15日:中检院关于征求《人工智能医疗器械 冠状动脉CT影像处理软件 算法性能测试方法(征求意见稿)》等2项行业标准意见的通知
- 2022年7月15日:中检院发布关于征求《用于增材制造的医用β-磷酸三钙粉末(征求意见稿)》等2项行业标准意见的通知
- 2022年7月22日:国家药品监督管理局医疗器械技术审评中按照《医疗器械标准制修订工作管理规范》,起草完成了《重组人源化胶原蛋白》(项目编号N2022001-T-qs)标准和验证工作,经2022年7月4日的标准草案研讨会充分研讨,现已形成征求意见稿(附件1)和标准编制说明,并将于2022年7月23日至2022年8月22日进行广泛征求意见。
- 2022年7月12日:国家药品监督管理局经审查,批准了杭州启明医疗器械股份有限公司生产的创新产品“经导管人工肺动脉瓣膜系统”注册。
- 2022年7月13日:国家药品监督管理局经审查,批准了航天泰心科技有限公司生产的“植入式左心室辅助系统”创新产品注册申请。
- 2022年7月13日:国家药品监督管理局经审查,批准了西安大医集团股份有限公司生产的“伽玛射束立体定向放射治疗系统”创新产品注册申请。
- 2022年7月15日:国家局发布2022年6月共批准注册医疗器械产品193个。其中,境内第三类医疗器械产品139个,进口第三类医疗器械产品26个,进口第二类医疗器械产品25个,港澳台医疗器械产品3个。
- 2022年7月19日:国家药品监督管理局经审查,批准了北京朗视仪器股份有限公司生产的“耳鼻喉双源锥形束计算机体层摄影设备”创新产品注册申请。
- 2022年7月27日:国家药品监督管理局经审查,批准了深圳北芯生命科技股份有限公司生产的“血管内超声诊断仪”和“一次性使用血管内超声诊断导管”2个创新产品注册申请。
- 2022年7月8日:国家局公布注销武汉港基医学技术有限公司以下1个产品的医疗器械注册证书:一次性使用压力延长管,注册证号:国械注准20193030907;Micro Vention,Inc.以下1个产品的医疗器械注册证书:弹簧圈系统,注册证号:国械注进20153133397。
- 2022年7月18日:国家药监局关于发布国家医疗器械监督抽检结果的通告 ,通告内容为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对手术衣、一次性使用腹部穿刺器、小型蒸汽灭菌器等3个品种进行了产品质量监督抽检,发现4批(台)产品不符合标准规定。
- 20227月20日:国家药公布了对四川拜阿蒙生物活性材料有限责任公司飞行检查情况,检查发现该企业质量管理体系主要存在机构、人员、厂房设施、设备、采购、生产管理方面缺陷。
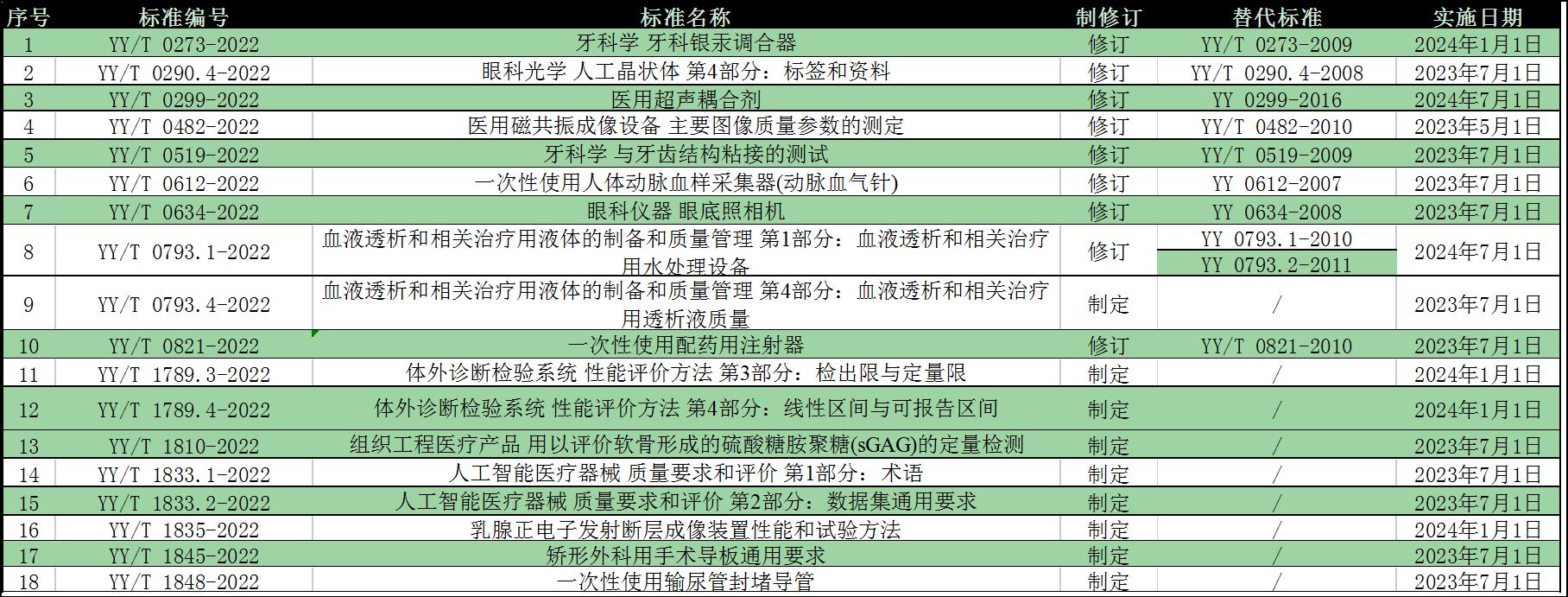
- 2022年7月6日: 国家药监局发布YY /T 1833.1-2022《人工智能医疗器械 质量要求和评价 第1部分:术语》等 18项医疗器械行业标准的公告
- 2022年7月22日:医疗器械技术审评中心公开征集6项医疗器械行业标准制修订计划项目第一起草单位工作。
发布于 2022-07-30 15:59:33 © 著作权归作者所有