对于仿制药一致性评价来讲,期望通过一致性评价的缓控释制剂从研发到生产,药物在体内的疗效,要做到与原研药保持高度的一致性,生产出来的产品质量持续稳定可靠,在产品的全生命周期中都要保持稳定。
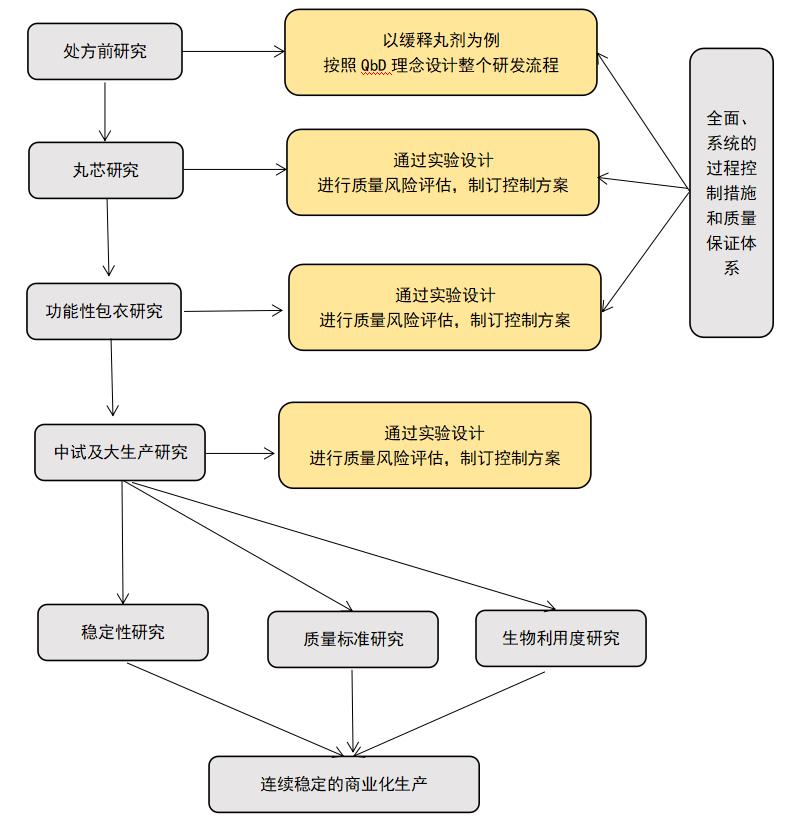
结合口服缓控释制剂的仿制从研发到生产的关键因素,如果要做一个缓控释制剂微丸类型的仿制药,仿制就要同原研药物,包括体外的药学等效,前期相关的研究大多先在实验室进行,包括工艺、处方、质量包括释放行为、稳定性的对比。我们也不要小看了前期的实验室研究,实验室研究是否充分,是否把握住了重点,直接影响到后面大生产的关键步骤。而另一方面对于生物等效性是否等同于原研药,这个才是“金标准”。对于仿制药来说就是通过预BE,缓控释制剂通常都会做预BE。研究药品在体内的释放,体内的预BE和体外的预BE怎么样能够产生关联,如果没有这样的关联,怎样才能够体现出体内的释药行为。
在初始的研发阶段,开发初期能够做能符合BE的产品,在后期放大后,如何能放大后依旧很“稳”,难点也在于“稳”,一致性评价不是一次性评价,要保证药品的全生命周期都符合。
仿制药研发示意图
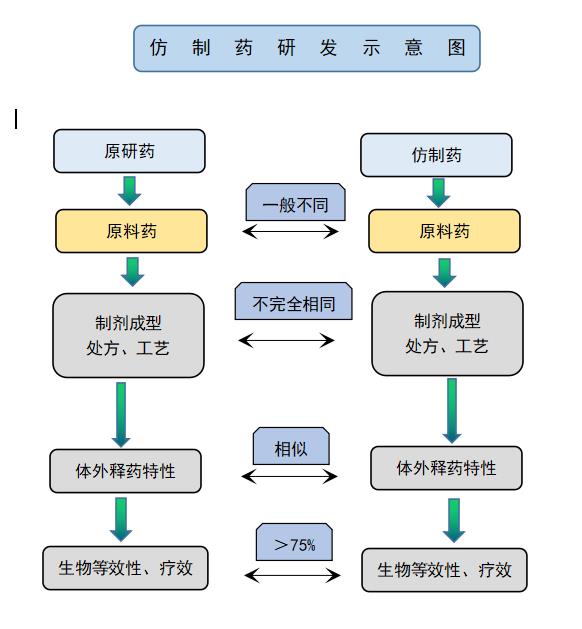
由于制剂处方工艺是药物的核心技术,在原研药高度保密的情况下,仿制药厂在仿制时在技术上的深入和突破便显得尤为重要。要想了解原研药制剂内在品质的具体情况及其所蕴含的高科技,就需要采用全面整体的研发思路、客观的质量控制评价手段来指导研发。
现在强调的是QBD的理念,另外就是释放度试验是有效的监控质量的方法。监控由始到终。依据此念,根据临床需要和药物的特点,以及积累和创新知识的经验来识别药品的质量概况,对于关系质量属性进行充分的理解。
其次设计产品的处方和工艺,确定研究重点,包括物料性质、丸芯的准备及粉体性质、包衣剂类型及释药性。考虑影响关键质量属性的因素如:API溶解性、渗透性、稳定性、辅料的理化性质,丸芯大小及其粒径分布,片剂的硬度和脆碎度、表面形态和内部孔隙率。生产过程中的包衣温度、风速、风温、雾化压力大小,包衣液中的阻滞剂、增塑剂、致孔剂的种类、比例及包衣液黏度、包衣增重及包衣膜的通透性等。包括但不限于这些,依此来建立质量控制手段。
采用试验设计同,确定影响一个过程及其结果的多个因素之间和它们与CQAs之间的相互关系,确定关键物粒特性、关键工艺步骤及关键工艺参数变化的范围。
通过工艺的稳健性研究将试验研究中确定的多因素操作区间确立为“设计空间”。
确认产品/工艺产生变异的根源并设定“控制空间”、制定控制措施。保证在研发过程中在可行性研究、小试、中试、商业化生产中产品质量优良且稳定。
为了研发中与原研药物的“同”及以后在生产过程中的“稳”,在自始至终均需关注,药学等效特性,制剂的关键属性与辅料的关系与控制。再一个就是生物等效性,制剂的体内外关系与关键属性(释放度)的关系控制。