11. 为什么 2D 胶上的蛋白点有横的和竖的脱尾?
横的脱尾可能是: 1 )一向等电聚焦不完全; 2 )某些蛋白质本身的原因(糖蛋白); 3 )蛋白的丰度太高。竖的脱尾是因为跑二向时,蛋白的溶解度不好。
12. 什么成分会影响 2D 胶的效果?
核酸,盐,去垢剂等等。
13. 2D 胶的上样量应该在什么范围?
上样量和样品有关。样品内蛋白种类多的上样量要大些,这样每个点才有足够的量被检测到。一般的全细胞裂解体系,上样量大概在 100 微克(银染)到 500 微克(考染)之间。
14. 我的蛋白质浓度很低,应该用什么方法来浓缩?
蛋白质的浓缩有很多方法。大致有超滤法,沉淀法和透析法。超滤比较温和,对蛋白质不会有修饰和改变,蛋白的种类一般不会有丢失。它的缺点是总样品的量可能会减少(被膜所吸附)。另外超滤对样品的要求比较高。甘油,去垢剂都会堵塞滤膜,影响超滤的效果。沉淀法比较快速,容易操作,对盐,甘油,去垢剂的耐受性好。缺点是可能会有部分种类的蛋白没有被沉淀下来(丢失)。沉淀法中,又以 TCA 法最为普遍使用。使用 TCA 法时,一定要用冷的纯丙酮清洗蛋白沉淀两次,去处残留的 TCA 和其他沉淀下来的杂质。透析法只使用于量比较大的样品,量小时,操作困难。 透析法可以和超滤法联用。先把样品透析到一个比较干净的环境( 不含盐,甘油,去垢剂或其它杂质,比如碳酸氢氨溶液),然后再进行超滤。
去除杂质—关键是尽量不丢失蛋白和减少蛋白修饰
核酸的去除:
对电泳的影响:增加样品粘度,于蛋白质形成复合物后会出现假象迁移和条纹.
解决方法:用适量的不含蛋白酶的核酸内切酶进行降解,或是利用合成载体两性电解质同核酸结合形成复合物的能力,再通过超速离心来去除复合物.
多糖的清除:
影响:带负电的多糖会与蛋白形成复合物,导致托尾和影响聚焦.
解决:用超离心和高pH,高离子强度,和TCA等沉淀法.
去污剂的清除:
影响:SDS能与蛋白形成带负电的复合物,对等电聚焦影响大,需要清除.
解决:用含载体两性电解质或两性离子去污剂的溶胀液稀释,或丙酮沉淀.
盐离子和外带电小分子的清除:
影响:样品中的盐增加凝胶条的电导,使其无法达到设置的电压,从而影响蛋白质聚焦,带电小分子会引起水的流动,使胶条的一端肿胀而另一端变干,导致两端的酸碱性蛋白无法聚焦,造成托尾或丢失.
解决: 透析去除盐成分,TCA-丙酮沉淀法可以清除小分子.
15. 蛋白质从一向(IPG胶条)到二向(SDS凝胶)的转移为避免点脱尾和损失高分子量蛋白,应缓慢进行(场强小于10V/cm)。
16. 第二向电泳中,用Mini Protein 3电泳槽时,以电流为标准,开始进样的低电流为5mA/gel,待样品在浓缩胶部分浓缩成一条线后,再加大电流到10-15mA/gel;以电压为标准,开始进样的低电压为50-75V/gel,待样品在浓缩胶部分浓缩成一条线后,再加大电压到150-200V /gel。用Protein II电泳槽时,以电流为标准,开始进样的低电流为10mA/gel,待样品在浓缩胶部分浓缩成一条线后,再加大电流到20-30mA/gel;以电压为标准,开始进样的低电压为75-100V /gel,待样品在浓缩胶部分浓缩成一条线后,再加大电压到300-400mA/gel。
17. 平衡过程导致蛋白丢失约5%-25%,还会使分辨率降低,平衡30分钟时,蛋白带变宽40%,所以平衡时间不可过长。如果不经平衡,把等电聚焦凝胶直接放在第二向凝胶上会导致高分子量蛋白的纹理现象,并且等电聚焦凝胶会粘在SDS胶上。缩短平衡时间可以减少扩散,但同时会减少向第二向的转移。所以平衡时间要充分长(至少2×10分钟),但也不要超过(2×15分钟)
18. 每根胶条蛋白质的总上样量由特定的样品,胶条的pH范围,及最终的检测方式决定。下表是进行银氨染色时的蛋白质上样参考.
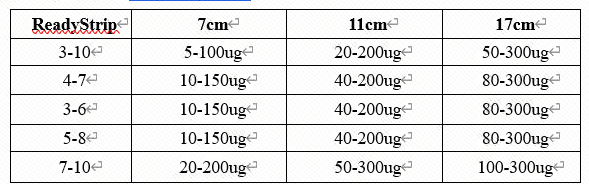
19. 所有包含尿素的溶液加热温度不超过30℃,否则会发生蛋白氨甲酰化。引起蛋白质pI值的偏移
20. 当样品中含盐量较高时,建议选用慢速升压。当样品中含盐量一般时,选用线性升压。当样品中含盐量很少时,可以选用快速升压,这样可以节省聚焦时间。

