一、概念:
二、分类:
微小偏差:,个人建议:必须立即采取CAPA措施,必须记录在批生产记录或其他GMP受控文件中。
主要偏差:个人建议:必须进行深入调查,查明原因,采取CAPA进行整改。需再批生产或其他GMP受控文件中说明,如见《偏差处理单》
严重偏差:个人建议:必须按规定的程序进行深入的调差,查明原因。出必须建立纠正措施外,还必须建立长期的预防措施。必须在批生产或其他GMP受控文件中说明,如见《偏差处理单》。
三、偏差管理流程
采取基于风险的管理方法,流程包括以下步骤:
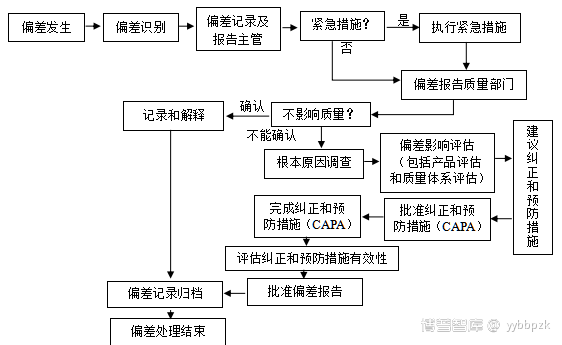
原辅包装材料、产品检验结果超标、产品储存异常、设备故障、检验结果超标,环境监测结果超标,客户投诉等,一旦发生(发现),操作人员应立即记录并报告。
四、采取紧急措施
偏差有时会涉及安全问题或者其他紧急情况,必要时,发生偏差部门的主管根据公司的安全程序或其它使用的程序,判断并执行偏差的紧急处置,以防止偏差继续扩散,并增强潜在受影响产品的控制(如增强放行控制)。
五、常见的紧急措施包括:
暂停生产
物料或产品隔离
物料或产品分小批
设备暂停使用
紧急避险等
其中,“物料或产品分小批”是指在发生偏差时,为了避免,减少可能损失,如果可以的话,生产人员应及时对产品做好标记,将发生偏差前,偏差中、偏差处理完恢复正常后产品分开,单独作为若干小批。分批后,质量管理部在评价时,可以针对发生偏差的小批做出专门决定,以免一旦需要报废,因无法区分偏差、后的产品而不得不将整个批号全部做报废处理。
执行的所有紧急措施必须在偏差记录中进行及时完整详尽记录。
偏差报告质量管理部门
自偏差发生时期1天之内,发生偏差部门的主管、技术人员或其授权人员应立即向质量管理部提供真实全面的偏差信息。
接到偏差报告后(或现场检查时发现偏差时),质量管理部门应迅速进行偏差的分类,分类的方式和原则见4.2
六、根本原因调查
组织部门调查团队,该团队的成员通常包括以下人员:
质量控制的相关负责人
注册、法规的相关负责人
质量保证的相关负责人
调查的目的:了解偏差如何或为什么发生;了解偏差发生时的情况、决定是否有其他产品受到影响;帮助确定根本原因和有效的纠正行动。
偏差调查应注意:
调查的深度应与偏差的风险水平相当
偏差调查方法
偏差调查的方法包括:
审核记录文件
检查测试产品物料、产品
检查设备厂房
观察操作、审核过去同类偏差、试验等
七、根本原因
偏差根源分析
根本原因通常来源于系统的缺陷(如不适当的规程、物料、设备、厂房或不合格的人员)、系统的实施缺陷或个人行为缺陷。
进行全面的根本原因分析的方法包括:集体讨论(头脑风暴);鱼骨图(风险管理);失效模式与影响分析(通过问五次
个人建议:即使没有找到根本原因,也应该记录所有活动和结论。
偏差影响评估
在识别根本原因的基础上,才能对偏差的影响范围和程度进行正确的评估。偏差影响评估通常包括两个主要方面:
对产品质量的影响,包括但不限于:
对直接涉及的产品质量的影响;
对其他产品的影响。
进行偏差影响评估时应包括可能受该偏差影响,但已被销售的相关批次。
八、对质量管理体系的影响,包括但不限于:
对验证状态的影响;
对上市许可文件/注册文件的影响;
客户质量协议的影响。
调查根本原因和进行影响评估可以采用风险分析方法,请参见《质量风险管理规程》(SMP-QA-023)。
CAPA
基于根本原因调查和偏差影响评估的结论,各相关部门应提出具体的纠正行动以消除偏差的影响,这些措施应明确相关的负责人和执行时限。
各相关部门同时提出具体的纠正预防措施以防止相同或相似的偏差的发生或再次发生。CAPA也应明确相关的负责人和执行时限。常见的纠正预防措施包括修改程序文件,重新培训,改进相关的系统等。
质量管理部负责审核批准相关部门或独立负责偏差调查和影响评估的人员所建议的纠正行动和纠正预防措施。个人建议:必要时应对所建议的纠正行动进行补充或修订,以充分保证药品的安全性和有效性。
九、完成纠正行动
相关部门应遵照已批准的方案执行纠正行动,在执行过程中,如因客观原因不能完全符合原方案的要求(例如完成时限等),应及时与质量管理部进行沟通;如果需要部分修改原方案的,应重新获得质量管理部门的批准。
评价有效性
评价有效性的方法包括:审核偏差追踪系统,以确定偏差是否正如预料减少了或消除了;使用自检规程,以确定是否消除了问题;进行产品年度回顾时检查相关的文件,以确定纠正行动是否有效地解决了问题;进行产品年度回顾时检查相关的文件,以确定纠正行动是否有效地解决了问题;根据变更,寻找未预料到的不良后果。
十、偏差调查报告
批准的纠正行动执行完毕和评价有效性后,相关部门应提交纠正行动完成情况的报告,由质量管理部门审核批准,一般在
偏差调查报告一般应包括:题目;背景资料;偏差描述;相关的调查;结论;整改及预防措施(CAPA);跟踪及趋势;附件等。
偏差处理单编号为D+年+月+序号的原则;
药品上市许可持有人产品的偏差管理规定;
次要偏差由受托生产企业按企业偏差处理流程完成,需告知药品上市许可持有人(委托方)。
个人建议:
十一、偏差资料管理:

