一、导论
2010年版GMP明确提出“企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制,确认或验证的范围和程度应当经过风险评估来确定”。因此,从法规角度必须在验证过程中使用风险评估的方法,以确保药品的质量和用药安全、有效。ICH(人用药品注册技术要求国际协调会议,the International Conference on Harmonization of TechnicalRequirements for Registration of Pharmaceuticals for Human Use)Q9《质量风险管理》是质量风险管理的基准指南,被世界各国的法规、指南所采用。它提出的风险评估理念、方法和工具也为验证过程中的风险评估提供了指导。[1]
二、什么是风险评估
风险评估是在风险管理过程中用以支持风险决策的系统性的信息组织过程,具体包括识别危害以及评估暴露于这些危害的相关风险。
风险评估包括识危险因素与暴露在这些危险因素定义于后相关风险的分析和评估。质量风险评估开始于一个明确的问题或风险问題.当被讨论的风险被明确定义后,则将会很容易确定适当的风险管理工具和需要用于风险问题说明的资料类型。[2]
通常将风险理解为,风险是由伤害发生的率及伤害严重性结合而成,然而,在不同的风险涉众中达成对风险管理应用共识仍是困难的,因为每个风险涉众可能感觉到不同的潜在伤害,对每个所发生的伤害设置不同的慨率以及伤害不同的严重性属性,对于药品来说,尽管有多种的风险涉众,包括患者、医疗从业人员,以及政府和业界,运用质量风险管理都应该以保护病人为基本出发点。[2]
三、风险评估的重要性
国际药品监管部门越来越强调加强对一系列物料属性、制造工艺选项和工艺参数的产品性能的增进和了解,以识别其中涉及到的患者安全和产品质量有关的风险。虽然了解质量风险管理 (QRM) 的要素很重要,但了解如何在药品制造过程中应用这些要素,对于有效的过程性能和控制尤为重要。风险分析和管理是一种可接受且有效的方法,可以最大限度地降低患者风险并确定适当的验证和控制水平。总之,风险评估的重要性体现在:
(1)它是监管者期望的工具,因为它有助于确保产品质量,从而确保患者安全。
美国食品和药物监督管理局 (FDA)、欧洲药品管理局 (EMA)和许多其他监管机构强烈建议在做出与产品开发、制造和分销相关的决策时,使用风险评估并考虑有关患者安全和产品质量的风险。
(2)它是一种良好的商业实践。如果使用得当,风险管理应该有助于确保产品质量,并促进资源的有效利用和工作的优先级。它应该可以帮助公司减少多余的和非增值的工作,并让他们专注于最有利于产品质量的工作。
(3)它是获取做出合理质量和业务决策所需的有用信息的合乎逻辑且有效的手段。风险管理代表了一种用于获取、分析和交流有用信息的有组织的方法。这方面的一个例子是执行失效模式影响分析(FMEA),以利用来自不同专家组(例如工艺开发、制造、监管和质量保证)的知识,通过小规模实验来确定要表征的工艺参数。
四、风险评估的应用方向
风险管理原则被有效地应用于许多商业和政府的领域,包括金融、保险、职业安全、公共健康、药物预警,以及这些行业的主管部门,如今,尽管在制药行业也有一些运用质量风管理的例子,但其非常有限,且没有体现出风险管理能提供的全部贡献.另外,制药行业已经认识到质量体系的重要性,而且,质量风险管理对一个有效的质量体系来说,是一个有价值的组成部分这一点越来越明显。[2]
在当今的商业环境中,高效制造优质医药产品是一项挑战。如果控制不当,这些挑战可能会对产品质量和患者安全构成重大风险。当今商业环境呈现独特挑战的原因有很多,包括:
●需要了解并遵守不断变化的监管要求和期望。
●创新技术与现有制造方法的使用和整合。
●使现有的生产方法适应新产品和剂型。
●由于工厂和资产的整合,设施的重新装备以及产品和技术的转让。
●因减员和重组而失去经验丰富的员工。
●需要更好地了解复杂工艺中物料、技术和产品的相互依赖性和可变性。
●需要最大化生产力和最小化成本。
●需要控制工艺以实现多个工厂和地点间的质量一致并保证产品供应。
设计制造工艺和相应控制策略的人员需要意识到这些流程步骤中固有的相关风险。在这种情况下,工艺失效的相对风险可能会对产品质量和患者安全产生不利影响。对产品质量的不利影响是质量属性的损失。质量属性是定义产品的那些元素或功能。对于医药产品,这些属性包括:
●规格——活性物质的含量、效力、有效性。
●安全性——不会造成伤害、污染,导致无菌或稳定性的丧失。
●纯度——无异物、无污染。
●身份——它声称是什么,批号、有效期。
在制药行业,我们主要关注患者安全或公共福利的风险。
产品质量的损失会导致对患者安全的不利影响。如果故障或意外事件在影响患者之前被发现并消除,那么就没有伤害。如果没有伤害,那么就没有风险。
因此,检测成为决定相对风险的重要因素。但是,应该记住,检测到工艺失效会导致产品的损失,但如果因此导致基础的药品供应中断的话,仍可能对患者造成伤害。
风险管理可以应用于制药过程的各个领域,从早期的过程设计/开发到维护经过验证的商业制造。ICH Q10 将产品实现的工具或推动因素描述为知识管理和风险管理,ICH Q9 讨论了各种风险管理工具,识别和使用适当的工具对于识别适用的风险非常重要。
五、风险评估的基本原则
在风险评估时,作为明确定义凤险的辅助工具,通常如下这三个基本问题是非常有用的:[2]
(1)什么可能出错
(2)会出错的可能性(概率)是什么
(3)结果(严重性)是什么?
风险评估的输出既是一个对风险定量估计也是一个对风险范围的定性描还,当风险被定量地表达,则运用数值表达它的概率。另外,风险还可以运用如“高”、“中”或“低”等定性描述词来表达,对其应该尽可能详细地确定。一些时候,使用“风险记分”来进一步确定描述风险的排列。在定量风险评估中,对一个风险估计能提供一个特定结果的可能性,给出一系列产生风险状况,因此,定量风险评估对于在某个时间的特定后果非常有用.另外,一些风险管理工具采用了相对的风险度量将多种级别的严重性和概率合并到一个完整的相对风险估计中。在一个记分过程的中间步骤有时候可以使用定量风险评估。[2]
风险评估方法按风险等级R(Risk,R)和风险优先级(Risk Priority Number,RPN)来进行评估。风险等级R可以根据风险严重性S和风险发生可能性的概率P来评估;风险优先级RPN则根据风险等级R和风险发生前可检测性D来评估,而最终的风险由风险优先级所RPN决定,计算公式为:
风险等级R=严重性S*可能性P;风险优先级RPN=风险等级R*可检测性D。
其中,严重性S指对患者安全性、产品质量以及数据完整性的影响(或其他危害);可能性P指故障发生的可能性;可检测性D是指在危害发生前发现故障的可能性。
为了使风险管理有用,风险评估必须尽可能准确。因此,客观、公正的评估和分析是关键。企业必须
●确保适当的利益相关者参与风险评估。
●使用适当的风险评估工具。
●在整个组织内以一致的方式执行风险评估。
●不要使用风险评估来验证职位或证明争议性工艺的合理性。
●使用多元化的评估团队以确保客观性。
●关注输出和结果。
●避免先入为主的决定或输出。
●文件记录以备将来参考。
●跟进和反馈计划。
●计划适当的沟通。
降低风险涉及采取行动和进行必要的改变。这些变化可能不会减轻所有风险,并可能增加其他风险。残留风险是在做出缓解措施更改后仍然存在的风险。识别并解决这些残余风险很重要。这并不意味着要避免因剩余风险而导致的缓解变化。另一方面,需要强调的是,在复杂的制造操作中,例如药品制造,不可能消除所有风险。需要接受低于某个阈值水平的风险。
六、风险评估应用实例
制药公司在制药过程中可能会在多个环节遇到风险,特别是口服固体和液体制剂。
本例侧重于固体制剂产品的制造。典型的固体剂量制造过程包括以下步骤:来料、分配/称重、制粒、干燥、研磨、混合、压片、薄膜包衣、刻标、包装和成品储存。
首先,最好从确定特定产品的所有制造步骤和输入端开始。
在风险管控过程中,常用到以下工具和技术技术:头脑风暴法、FMEA(失效模式和效果分析)、鱼骨图、HAZOP(危险与可操作性性分析)、FAT(故障树分析法)、流程分析法等[3]。
因果图(也称为鱼骨图)是实现此目的的有用工具。图 1 是鱼骨图的一个例子,其中列出了固体片剂制造中涉及的所有过程。在此鱼骨图中,鱼骨的上半部分包含制造过程的不同主要步骤,从在仓库(在鱼骨的头部)接收原材料开始到配制步骤(例如,分配、混合 ),到终成品加工步骤(例如,压缩、包装),并以成品存储在仓库中(靠近鱼刺尾部)结束。下半部分包含支持制造过程的组件:设施、设备和人员,这些组件都可能影响产品质量。
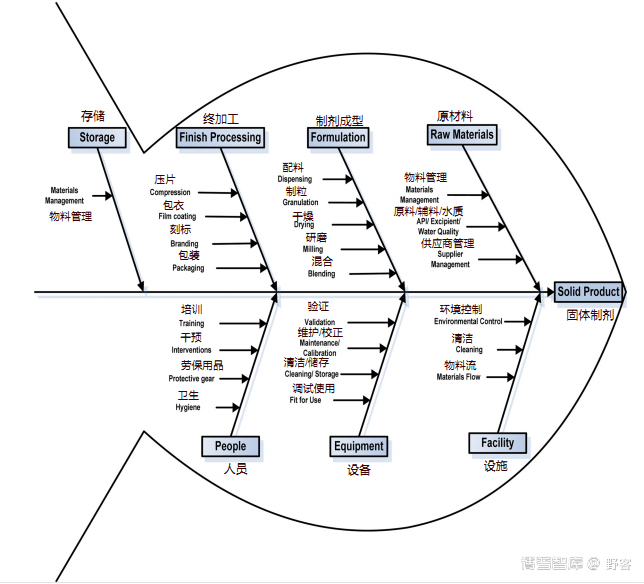
评估固体制剂制造过程中每个步骤的潜在风险。第一个考虑环节是进料。从接收开始,需要评估和保障将用于制造成品的物料的质量。表1列出了原材料的物料管理的潜在风险源和危害,从收到的物料到物料状态。这种分析可以应用于物料管理的其他领域,例如活性成分/辅料/水质和供应商管理,以及各种制造步骤。
表1.与药品生产中的原物料相关的潜在风险清单

在非无菌产品的制造过程中,微生物污染的风险一直是一个尚未明确界定的领域。通常,环境控制系统和监测数据已被用于控制和评估非无菌生产的微生物质量。然而,由于缺乏既定标准,非无菌工艺的环境控制和监测的应用范围从不存在到类似于无菌工艺的程序。在某些情况下,从程序生成的数据的类型和频率在确定产品制造环境的微生物质量方面可能没有多大价值。此外,数据的使用和解释方式及其对产品质量和对患者安全的重要性也存在不确定性。
可以应用基于风险的方法来了解制造过程,以确定可能发生微生物污染的位置,确定最佳控制水平,然后应用有效的监控方法以最大程度地减少成品的微生物污染。
首先确定可能引入或发生微生物污染的工艺步骤。
在工艺步骤中施加控制以消除或减少污染的可能性。这些控制提供了一种实时或近乎实时性能的反馈方式,因此可以在需要时及时进行更正或调整。为了最大限度地降低微生物污染的风险,需要应用技术和科学原理来控制设施、设备和生产过程引起的微生物危害。评估微生物危害的一种风险管理工具是危害分析和关键控制点 (HACCP)。
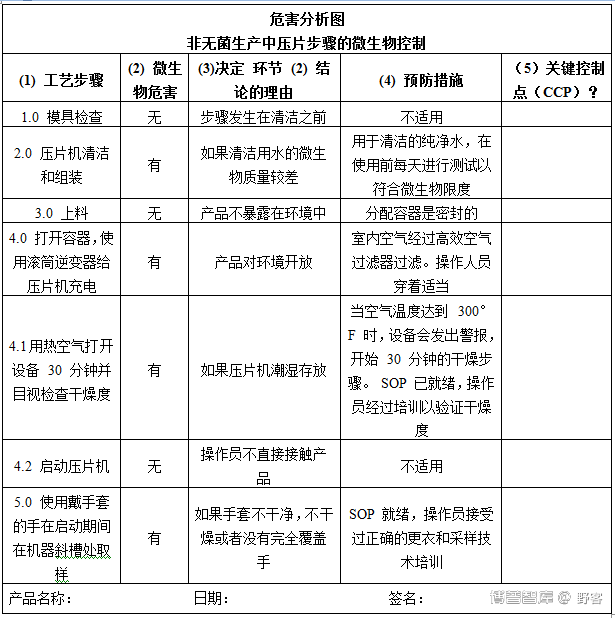
表2显示了 HACCP 在非无菌生产中的应用示例。
表2.固体制剂压片工序的微生物控制
CCP 决策树基于在每个步骤中回答五个问题来识别微生物危害:
1) 是否有任何危害?
2)做好有现行的预防措施?
3) 工艺步骤是否设计成消除风险发生的可能性?
4) 是否会发生危险或增加到不可接受的水平?
5) 后续步骤是否会将危害降低到可接受的水平?
决策树的使用促进了结构化思维和每个工艺步骤的一致方法。图 2 说明了流程步骤 4.1(表2)“用热空气打开设备 30 分钟并目视检查干燥度”的决策树分析。决策树分析得出的结论是该过程步骤是一个 CCP。
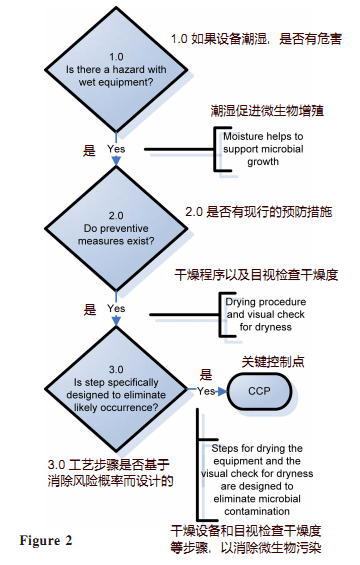
图2.HACCP决策树分析[4]
一旦确定了 CPP,就会使用 HACCP 控制图来记录 HACCP 计划。该图表将有关流程中存在 CCP 的步骤的所有基本细节保存在一处。对于每个 CCP,该图表定义了工艺步骤、潜在危害和原理、确保工艺步骤正确执行的措施,以及需要达到的预定义水平,以确保工艺步骤处于受控状态。此外,该图表还提供了监控类型、监控频率以及负责执行该步骤的人员。该图表还定义了未达到控制水平时要采取的步骤。
七、当前存在的问题和未来改进方向
2021年11月18日,ICH发布了新版 ICH Q9(R1)《质量风险管理》指南,该文件当前处于阶段3供各成员国征求意见(欧盟已启动),预计将于2022年9月最终确定进入阶段4供各成员国实施。ICH表示,ICH Q9的QRM原则和框架有助于将QRM方法引入行业和监管机构。然而,ICH Q9所设想的QRM的收益尚未完全实现。ICH认为QRM的当前应用有四个方面需要改进,其中在当前制药企业中广泛存在的一点是:当前的风险评估和QRM产出存在高度的主观性。究其原因可能包括高度主观的风险评分方法以及风险评估方式(例如使用错误的风险评分表)以及不同利益相关者如何看待危害,风险的差异。QRM的主观性可能导致风险管理的有效性出现偏差。修订后的《指南》指出了主观性如何影响QRM过程的每个阶段,特别是危害的识别和对其发生概率的估计,风险降低的估计以及QRM活动所作决策的有效性。ICH表示,虽然主观性不能从QRM活动中完全消除,但可以通过解决偏见,正确使用QRM工具以及最大限度地使用数据依据和知识来源来控制主观性。[5]
参考文献
[1] 风险评估在新建制药项目验证中的应用,韩源,法规验证与装备,2015
[2] ICH Q9《质量风险管理》
[3] 关于制药项目执行过程中的风险评估探讨,卢海,科学研究,2020
[4] A practical discussion of risk management for manufacturing of pharmaceutical products,A. Hamid Mollah etc., 2014,PDA J Pharm Sci and Tech
[5] 《重磅,新版ICH Q9<质量风险管理>来了!》,“GMP办公室”微信公众号,2021-12-19

