FDA 483是什么?
FDA 483 报告(缺陷报告)是FDA(美国食品和药物管理局Food and Drug Administration)检查官根据cGMP 规范,对医药企业的质量体系进行现场检查过程中所发现的不符合cGMP 之处列出的总结清单。对企业而言,它可以指出企业质量管理的缺陷,引导和激发企业改进和完善质量系统,使其达到cGMP的标准。根据检查结果,检查官填写观察项(observation)并提交FDA483表格,与公司管理人员进行讨论。受检企业则需要对其进行正式回复,将其针对FDA483表中缺陷项所制订的CAPA措施在规定时间内提交至FDA,然后迅速实施这些纠正措施计划。不知道是不是有人会和我一样疑惑过483的含义?其实483只是FDA内部的一个编号,与公司内部的某个受控表格号类似。
FDA 483包括哪些内容?
该表主要包括以下内容:受检公司,受检地址,受检身份,检察员信息,检查日期,签发/发布日期,缺陷标题和具体描述(缺陷现状和违反内容)等。
FDA 483与警告信(warningletter)一样吗?
不一样!FDA483上提出的观察项,是给予工厂解决时间的,只要找到根本原因,针对性地解决问题,并制定合理有效的CAPA措施,及时在规定时间内反馈到FDA,那么很多观察项可能不会升级为警告信。FDA 警告信的定义:用以通知被监管者在FDA的检查中或调查中有被记录在案的违法事实的一种信件。如果一个问题反复出现,且没有得到针对性的、及时的解决,可能会促使FDA出具警告信。FDA483观察项的多少与工厂实际最后拿到的警告信是无关的。
收到FDA483后续?
在FDA审计之后,收到FDA483之后该怎么做?企业能做的首先就是及时回复!与FDA积极主动进行沟通,明确问题所在,在规定时间内(15天内)进行回复,回复正文简明明了,对483中的每一条缺陷进行逐条回复,调查根本原因,列出相关的改进措施、方法和明确的任务时间线,对已完成整改措施提供完整证据。
FDA483 有哪些观察项?
图12020财年FDA 483报告统计
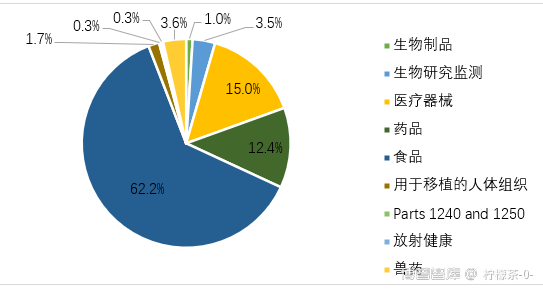
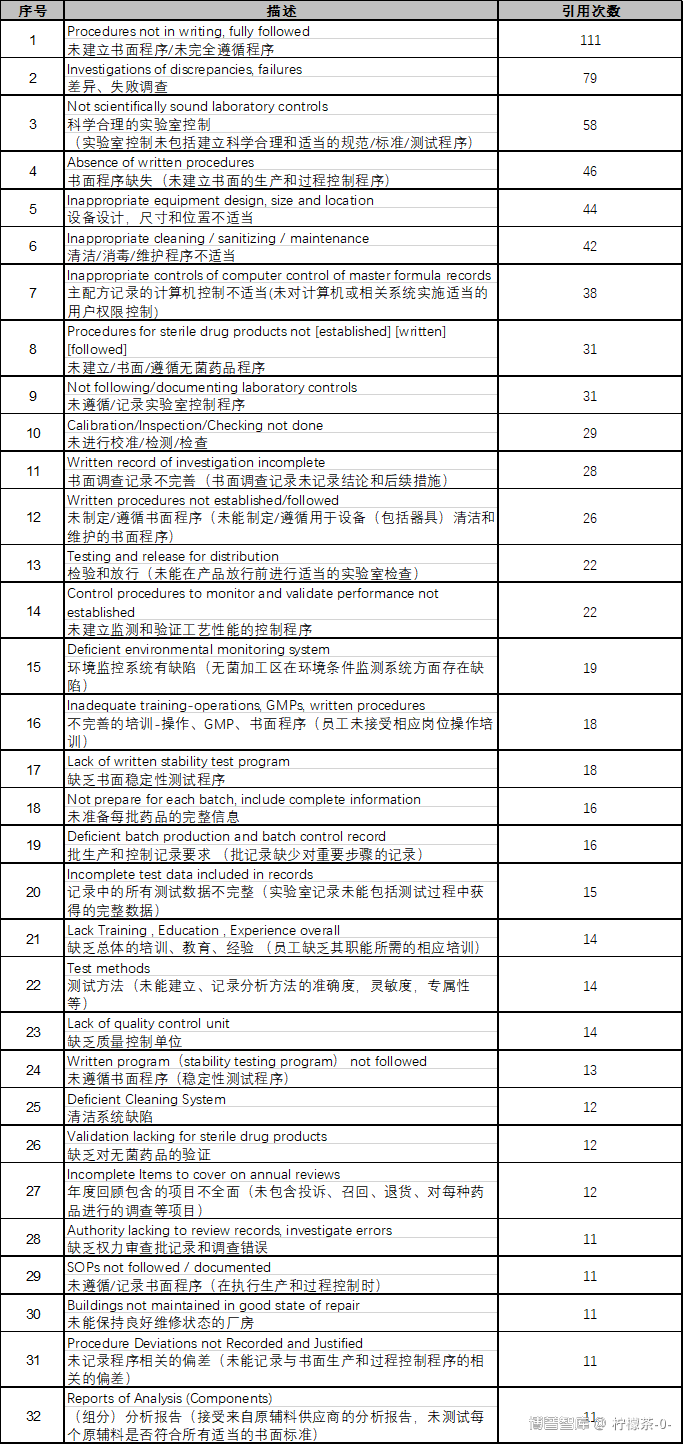
针对药品来说,该总结报告中共有286条相关的法规条款引用,共引用次数为1514次 。其中重复引用10次以上的条款有32条,共引用次数为855次,占总引用次数的56%,因此,本文着重看这部分引用较多的条款,它们能基本代表制药企业普遍存在的一些问题。这些条款大多都是引用了CFR211,CFR211是联邦法规中对制剂药品的CGMP要求,也是引用最为频繁的法规。下表为引用次数较多的32条缺陷。
文章来源:药事纵横

