本文对应原文件第11、12部分 点击蓝色字体查看并下载原文文件:CAPA Root Cause Investigation
【翻译 PⅠ】CAPA Root Cause Investigation
【翻译 Ⅱ&Ⅲ】CAPA Root Cause Investigation
【翻译 Ⅳ&Ⅴ】CAPA Root Cause Investigation
【翻译 Ⅵ&Ⅶ】CAPA Root Cause Investigation
【翻译 Ⅷ】CAPA Root Cause Investigation
【翻译Ⅸ&Ⅹ】CAPA Root Cause Investigation
11
当观察到一种不必要的情况(通过直接观察症状或某种通知,如投诉)时,所采取的行动对于限制可能以伤害的方式对有价值的东西-人、产品、设施、材料、设备-的影响可能是很重要的。 当观察及时与事件实际发生时断开连接时,例如,趋势分析朝不必要的方向进行或严重的患者投诉,那么可能会需要紧急措施,但将与实际事件在进展中或发生后发生时截然不同。 在这一章中,我们将研究如何防止问题变得更糟。
紧急措施
早些时候,我们将紧急措施定义为:为阻止事件或不符合情况恶化而采取的行动。 换句话说,好比“止血”。因为偏差而开始调查后采取的措施不会被认为是紧急措施。
采取的具体行动过程是高度可变的,显然取决于事件,但往往可以基于几个原则,包括:
•预防:通过关闭、关闭或转移危险来解决问题的根源。 这减少了其他有价值的东西受到影响的可能性。
•隔离:隔离受损害来源(即危害)影响或可能受影响的物品)。
•通知:向利益相关者传达正在发生或已经发生的事情。 这可能包括组织管理人员、医疗保健专业人员、病人和监管官员。 通常有一个上报程序,以确保公司内部的适当管理水平人员被告知。 在某些情况下,如向美国FDA提交现场警报报告(FAR),有要求必须在三天内提交FAR。
其中一些直接的行动可能是自发的、基于一个人的知识和经验采取的措施。 在理解来自事件的信号时,建立一个系统中的组件如何组合在一起的心理模型是很重要的。 运用基于风险的思维也很重要。 一个人想问的两个问题是:如果采取行动,有什么风险? 如果什么都不做,有什么风险?
紧急措施也可以在程序或清单中详细说明;每个可能参与的人都应该接受关于这些行动的培训。 这个过程可能是非常非正式的,就像使用助记符一样,例如使用灭火器时适用的PASS(拉安全销、瞄准、挤压手柄和将灭火材料排放到火焰底部的喷嘴)。 在其他时候,行动可以在清单或程序中得到很好的定义,并加以实践。
就算正在采取紧急措施,也必须保存在调查中可能重要的任何证据。 例如,在事件稳定后拍摄的样品和照片可能有助于理解原因。
纠正(Corrections)
国际标准组织(ISO)将纠正(correction)定义为:“消除检测到的不合规的行动”(ISO9000:2005-3.6.2)。 与此定义相关的有两个注释:
注1-纠正可以与纠正措施(3.6.5)一起进行;注2-纠正可以是,例如返工(3.6.7)或重新评级(3.6.8)。
在制药界和生物制药界,纠正可能意味着拒绝原料。 在制作药物产品剂型时,通常不可能或不允许返工或再加工;在生产原料药(API)时,可能允许返工或再加工)。 在进行返工或再加工之前,必须考虑营销授权或产品批准/注册。
在某些情况下,紧急措施也可以作为纠正-例如,在最初犯错误时纠正批记录上的条目。 如果立即采取的行动与下一步采取的行动之间存在时间差,那么这一差距将立即采取的行动与纠正措施分开。 例如,如果灭火系统中的喷头(有时也称为“滴水”)被损坏,并发生水灾,立即采取的行动之一将是关闭水源。 更正将是更换喷头,丢弃被水损坏的物品,并清理混乱。
结论
当事件发生时,立即采取的行动可以在局势的范围和影响方面产生重大影响。 在某些情况下,对系统和常识的了解可能就足够了;在另一些情况下,需要有一定程度的准备(“以防万一”),甚至可能需要一份清单或程序。
不要花很多时间来决定某件事是紧急措施还是纠正。不过一定要为自己所采取的行动记录下来。
12
在理想的调查过程中,将会有证据指出不必要事件的原因。 这些可能是一些根本原因,近端原因,可能是一个或多个促成原因的组合。 至关重要的是,根源和近端原因通常是“可采取行动的”-也就是说,您可以确定可以设置的特定控制措施,以防止它们再次发生。
在前文中使用了全球协调工作组的话(GHTF,2010年),我们将纠正措施定义为:
•消除检测到的不合格原因或其他不良情况的措施(3.6.2)
注1:不合格的原因可以不止一个。
注2:采取纠正措施以防止复发,采取预防行动(3.6.4)防止发生。
注3:纠正(3.6.6)与纠正措施有区别。
预防措施:
•消除潜在不合格原因的或其他不良情况的措施(3.6.2)
注1:不合格的原因可以不止一个。
注2:采取预防措施以防止发生,采取纠正措施(3.6.5)以防止复发。
注3:纠正(3.6.6)与纠正措施有区别
由于不想要的事情发生了,你想不让它再次发生,你正在采取纠正措施。
有些人想着什么是预防措施后陷入思维僵局。 举个例子:现场(SiteA)有问题,另一个现场(SiteD)有类似的过程,但仍没有经历这个问题。 实施控制以防止在A现场再次发生将是纠正措施;在D措施实施相同的行动以防止事件将被视为预防行动。 在A站点的不同区域实施控制呢? 您可以将这两种行动称为预防行动;大多数从业人员将其称为预防行动,因为这一问题没有发生在该领域。 正如我们在其他问题上所说的那样,不要让自己在这是否是一项“真正的”预防行动上分心。 重要的是,我们不希望事件发生或再次发生。
在本章中,我们将研究可用于纠正措施或预防措施的选项的范围。 接下来是一些关于这些控制选项的局限性的重要提醒。
将纠正措施与原因联系起来
纠正不必要事件的最重要因素之一是,采取的行动解决了调查期间发现的原因。 如果没有找到或假设原因,纠正措施可能会浪费时间。 (如果仔细的调查仍找不到根源或近因,应该要采取的适当行动将在本章后面讨论。) 与根本原因不一致的纠正措施通常是为什么有效性检查中表明问题尚未解决的原因。
当选择要应用的纠正措施时,您的目标是根源和近端原因,而不是可能存在的促成原因,因为促成原因只会增加事件发生的可能性或事件本身的速度或强度。 找到减少或消除促成原因的方法肯定对你有利,特别是当这样做的努力或成本很低时。
变更控制和风险评估
如果您已经确定了一个或多个纠正措施来解决您的问题,并且您正在GMP中工作,请不要忘记变更控制。 根据所提出的建议,可能会有需要管理和监管/卫生当局审查和批准的行动。 如果不能确定这些问题,可能会导致延误和潜在的合规和监管问题。
您还应该考虑由于变更可能发生的新的或剩余的风险-这是前面讨论的风险管理过程的一部分(第6章)。 残余风险被定义为在纠正、纠正措施和预防措施到位后仍然存在的风险。 风险评估不一定要复杂。 对于大多数简单的建议纠正措施,五个问题可以让你通过这个过程:
1.什么会出问题?
2.有多大可能发生?
3.如果真的发生了,会有多糟?
4.我们需要做点什么吗?
5.我们有什么选择?
期待有效性检查
当你正在建立一个或多个纠正措施时,你如何知道它们是否会实现你的目标?如果有几个不同的大致相当的选项,那么一个选项可能比另一个选项更容易证明它已经成功实现并且是有效吗? 应该考虑规划您的有效性检查策略以确保正在把纠正措施落实到位。
纠正行动选项的范围
鉴于已查明的具体根源和近端原因,有许多选择可能是适当的。 其中一些清单和说明如下。 虽然没有绝对优先权清单,但有些行动比其他行动更可取;在下列清单开头列出的行动应在清单后面的行动之前考虑。
消除
如果你的原因表明某件特定的事情是不必要事件的原因,它能被消除吗? 例如,如果使用造成不可生存的微粒污染的纸板纸箱将物品运输到分类环境中,是否有可能处理纸板? 消除也适用于与过程相关的处理步骤或活动。 制作一个详细的流程图或过程图在这里是非常有帮助的。
消除危险(危害的来源)可能需要花些精力或需要创造力,但它可以大大节省组织的成本。
替代
如果不可能完全消除一种危险,那么可以考虑更换一种危险性较小的行动或材料。 例如,在设备准备区(C/D级或ISO-8级),洗涤/清洁部件被放置在塑料袋中并热密封。 不可行的空气样品表明,加热元件在密封袋时有时会产生少量的烟雾。 该公司取消了装袋/密封过程步骤,并将其替换为将零件放入干净的塑料手提包,其中有一个盖子可以紧密密封。 另一个例子是,在无菌处理区域,不使用常用的复印纸进行批记录,说明书印在可经热压处理的低脱落纸上。一些公司正在更进一步,用笔记本电脑代替纸质记录。
工程控制/自动化
消除“人为错误”的一种方法是不让人参与活动,这通常被称为“将人排除在外,以机器代替”。自动化验证过程可以提供一个高度的保证,即每次都会以同样的方式执行。 例如,一些公司使用机器人装卸冷冻干燥机,或者他们有高度自动化的无菌灌装线放置在隔离器中。
但是自动化不是万能的,下面将讨论。
隔离
隔离一种活动可以从它可能产生的不利影响中消除危险。 使用隔离器进行无菌灌装是一个明显的例子,也是将木托盘远离药物制造区域。 隔离可能是物理的(如将未经批准或拒绝的材料隔离),也可能是时间的(取决于时间和时间安排)。
警报或通知
在某些环境中,警报可以用来通知人员,例如,如果空气处理系统不能正常工作。 警报的类型-视觉或听觉-需要考虑到它将在哪里使用和在该领域工作的人员。 然而,警报的一个主要问题是警报疲劳-“当临床医生(例如在医院环境中)暴露于过多的警报中时,感觉过载,这可能导致对警报和错过警报的脱敏”(Sendelbach等人,2013年)。 研究表明,70%至99%的警报是假的(Gaines,2019年)。
表格和文件的设计
设计不良的表单是文档相关错误的主要原因之一。 例如,当人们必须在一个真正只适合50个字符的空间中插入200个字符的手写文本时,可读性问题经常发生,
一个环境监测小组正在使用纸质表格记录其控制区内可行和不可行的数据。 不同的人在不同的时间修改了表格,导致填写表格的人犯了许多错误。 致力于改进表单和减少错误的团队寻找“范例”数据收集部分,这些部分是最好的。 通过使用背景色(灰色阴影)和线条来抵消其他人填写的某些部分,这些都令情况得到了进一步的改进。 例如使用索引-白色和浅灰色的交替指令集,逻辑上分组相关数据集。
“提示”可用于提醒用户要包含的信息或格式。例如,在标题(例如,##月份(mon)## 日 月 年)中有一个格式为简便型的日期列,可以帮助作者正确地输入日期(例2020年10月22日),并帮助读者理解如何输入。
有标准化的脚注注释也可以帮助标准化和简化表单完成。
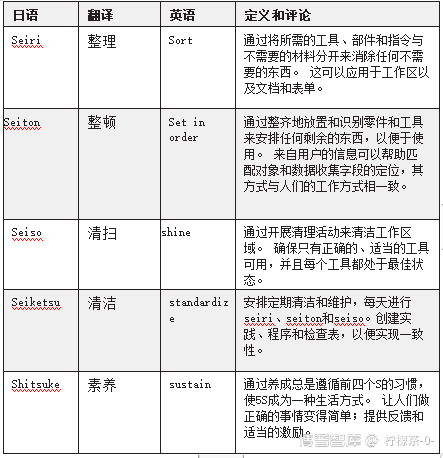
5S:整理,整顿,清扫,清洁,素养
这种方法起源于丰田汽车公司,作为对该公司开发的其他质量改进计划的补充。原始的5S和更多的字面含义如表1所示。
表1。 丰田5S系统的术语和定义(改编自ASQ,未注明日期)
解耦合或松耦合过程步骤或操作
一个紧密耦合的过程类似于火车上的车厢-一节链接着一节。 这意味着,如果发生问题,影响可以传输到其他连接单元。 你可以看到的一个地方是在地下地铁或铁路线的自动扶梯或机场的移动人行道中:它们通常被分解成几个较短的自动扶梯或移动走道,而不是一个很长的自动扶梯或移动走道。这意味着如果有什么东西坏了,这个问题就不会影响整个系统(例如,人行道、过程等。) 但只是其中的一部分。
解偶联的一个缺点是,它可能会使操作效率降低,因为多次的启动停止或被分解成了多个部分。 另一方面,如果有问题,一个不耦合的过程可以减少影响。
减少事件发生的频率
风险被定义为不必要事件发生的可能性和事件发生时影响的严重程度的组合。 通过减少做一些可能导致负面后果的事情的频率,你正在降低风险。 干预措施就是一个例子:通过减少干预措施的数量来降低污染产品的风险。
这一战略用于飞机的预防性维修(PM)(Reason等人,2003年)-一家航空公司做了一项研究,表明如果它们减少了某些PM的频率,它们可以减少潜在的问题。 (他们还发现在重新装配过程中最常见的偏差:零件可能被省略或安装不当。 )
改变来源
这一行动显然很简单,但可能会变得非常复杂,取决于所涉及的内容。如果在传入的组件中发现了大量的缺陷,可能最好改为不同的供应商,但这可能非常复杂,需要审计、资格样本、增加测试或检查等。
把资产复制
这是另一种可能变得昂贵和复杂的选择。如果供应商有质量或供应问题,拥有单一的材料供应商-特别是关键材料-可能是非常危险的。 因此,有第二个有资质的供应商是值得拥有的。另一个例子,应当应当由有一个合格的备用仪器,以防常使用的机器出现问题。 一些生产医疗必需产品的公司有自己的第二或第三个厂房(或合同制造厂房),如果其他厂房有某种故障,那么则有能力弥补短缺。
提供补充资料
如果没有其他可以做的,那么仍然可以选择提供额外的信息。 它没有被高度重视,因为简单地说,我们作为人,往往不阅读指示。带有电器的冗长的指导手册通常被缩短为一页的“快速启动”指南,通常带有图形。
更多的信息提供方式可以是标志或海报的形式-例如,将海报大小的照片显示正确的装饰顺序安装在装饰室。 如果使用这些类型的作业辅助工具,则需要将它们链接到基础文档或过程,以便可以应用适当的更改控制程序。
例如:一家公司的更衣室里有太多的人多次出现。 (通风系统和环境监测方案一次只支持三人。) 典型的标识(例如:不允许一次超过3人在此房间)似乎不起作用。 然后,他们改变了他们的方法,相比于给出一个指示,他们在门的窗户上用一个符号问了一个问题:“房间里有多少人?”后面跟着“如果已经满3人,请等到有人离开。 (最大限度:3人)。“在这样做时,他们利用了一点心理学:人们想回答问题。 如果一个问题一直悬而未决,我们心里有些不安。因此,在这种情况下,问题促使想进入该区域的人计算出房间里实际上还有多少人,然后开始遵循规则。 (是的,那个标志有一个独特的身份号码,把它与洁净服室的程序联系起来,这样它就会受到变更控制。) 另一个例子是在医院病人房间的门上看到的:你洗过你的手了吗?
添加或更改过程
通过更改程序来解决偏差是最常见的纠正措施之一。 结果是什么? 通常越来越多的细节被“栓在”程序上,通常没有有效的理由,除了需要做某事。当信息对使用该程序的人不正确或不清楚时,修改程序是适当的。
一个疫苗制造商有一个七页的程序,涉及蠕动泵的设置和操作。 某天,操作员安装油管时穿过了泵头的闸门(螺旋状)。当泵开始运行时,流体走错了方向,造成了大量的物质和经济损失。 调查组看了程序,决定修改。 他们没有在程序中添加一些内容,而是删除了大部分文本,将其长度从7页减少到3页。 这是通过三张照片来完成的:第一张照片,泵的样子没有油管;第二张照片,有人开始把油管穿过第一个闸门,指示正确的方向;第三张照片是油管完全到位。 采取的另一个行动是在泵本身上放置小箭头标签,显示油管和材料的适当流动。 从那以后,这家公司就再也没有发生过类似的事情。
由于程序的重要性,本话题中涉及更多细节见第13章。
培训
培训或“再培训”是另一个最常见的纠正措施,通常是因为没有调查或非常糟糕。卫生当局检查人员知道这一点,而有效性检查-纠正措施并没有防止复发-也显示了这一点。
一名检查人员在检查QC实验室时对一家公司使用了这个。利用该公司的培训记录,他指着一名员工,他接受了培训,再培训,并因实验室故障而重新培训。在对实验室经理指出这一点后,检查员说,这似乎是实验室的培训计划有一个重大问题;经理勉强同意这个观点。 然后,检查员向经理问了逻辑问题:“你刚刚承认你的培训计划是不够的。 那么,您怎么知道这个实验室分析人员生成的特定结果是在标准范围内的呢?你怎么知道,不仅仅是运气使一个坏产品被测试与一个好的产品的结果,因为,正如你刚才说的,你有一个不充分的培训计划?“检查员给经理提出了一个无法解释的问题。
虽然培训应限于真正知识或技能不足的地方,但活动及其解决办法应传达给所有利益攸关方。关于交流的更多细节见第19章;关于培训的更多细节见第14章。
特定于“人为错误”原因的纠正措施
如果调查使用了第8章中讨论的模型之一,并能够识别根本原因和/或近端原因,这些模型可以指导您采取更具体的适用行动。
例如,如果使用人类因素分析和分类系统(HFACS)工具(Shappell等人,1997年),你可以问三到四次“为什么”来确定一个更精确的原因。 例如,为什么人们经常违反程序? 你可能会发现,技术人员正在尝试两到三个目标-遵循GMP,获得所需数量的生产单位,并保持严格的时间表-并认为他们采取的程序捷径是“没什么大不了的”。继续问为什么会导致更广泛的组织问题(下面讨论)。
如果您使用第8章中列出的“事件前体”,这些本身就是可以解决的相当具体的条件/情况。 例如,如果调查表明,在准备样品时,实验室分析员增加了两次试剂,因为他们被其他事情打断了,那么纠正措施应在一定程度上限制干扰和中断。
防错(poka-yoke)
防止不必要的事件被认为是人为错误的最好方法之一是设法使该事件不可能发生,或使其立即被防错过程检测到(或如日语所述,poka-yoke)。通常,这将涉及某种设计或工程层面来解决问题。 如果你只考虑将电缆用于你的电子产品,那么可以预设到错误的预防措施将会被采取。 例如,视频源和电视之间的HDMI电缆只能以一种方式插入到设备中。 美国标准的120伏电子插头只能通过一种方式连接到电子插座上;连接到Ipad® 上的数据线可以用两面之一插入,它没有什么区别-这两种方式都有效。防错即使某人很容易做正确的事情。
“好言说服(Nudges)”
诺贝尔奖得主理查德·萨勒和法律学者卡斯·桑斯坦(CassSunstein)在他们同名的书中(Thaler等人,2009年)将好言说服(nudges)定义为积极的强化和间接的建议,作为影响群体或个人行为和决策的方法。好言说服是一种选择架构,它试图通过使用基于心理的线索来引导人们做出适当的决定或行动。 其中最引人注目的一次是在阿姆斯特丹的希浦机场实施的。 机场建成后不久,设施管理部门正在审查业务费用,并注意到这些费用在客房管理和清洁方面超出了预算。在多次询问“为什么?”时,他们发现清洁工花更多的时间打扫男厕所,特别是小便池周围。 微妙地说,问题是一些男人在使用该器具时的没瞄准。 为了减少目标差的问题,他们用刻在瓷器上的黑苍蝇的形象制作了小便池。(如果你不是男的,就问你身边的男人::目标在激励“目标”方面能做什么?)换句话说,解决方案的设计者使用了他们所知道的关于人们(即男人)如何思考和利用这一点的东西。
Nudges不只是简单地引导对象倾向于做正确的事情(例如,对于那些需要在笔记本上记录信息的人来说,只有黑色或蓝色的带不褪色墨水的笔可用),人类在做出决定后抗拒做出改变。 想要鼓励退休储蓄的组织通常会设定一个默认的储蓄预扣率,比如3%;新员工如果愿意,可以减少或提高。
使用Nudges有时被批评为以操纵个人或消费者的方式塑造行为。 杂货店以商品如何定位来建立销售而臭名昭著:中间货架(最容易到达)是为畅销书(或商店正在努力推广的),较低的货架是儿童感兴趣的产品,而底部货架是为最便宜的产品。
瑞士奶酪 (Swiss cheese)
当我们研究事故模型(第7章)时,我们正在考虑由于不存在或有缺陷的障碍(从概念上讲,由瑞士奶酪上的洞表示)而导致的失败是如何发生的)。 然而,这个模型可以用另一种方式来看待,奶酪切片代表的是为了防止复发而设置的控件。
瑞士奶酪模型所说明的一个重要概念是分层方法-你不仅依赖于一个控制,而且在初始控制失败时依赖冗余。与其只拥有一个控件来防止不必要的事件,不如拥有多个不“完美”的控件来防止事件通常更可行和可靠。 例如,我们不仅依赖于成品测试;相反,对来料进行了测试,以便它们可以放行供使用、过程中测试、合格设备和验证过程,所有这些都为产品满足其要求提供了信心。
验证,检查,复核
当人们参与不必要的事件时,应用的常见纠正措施之一是添加验证或检查步骤。 批记录和日志随后变得臃肿,有时每一步都由第二个人签名。
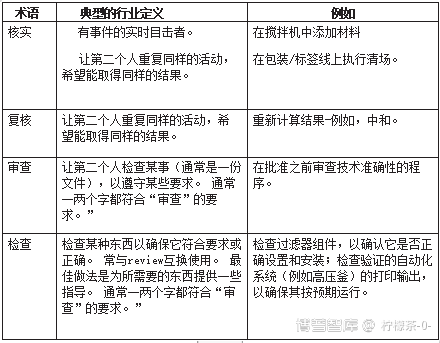
如果看来自不同国家和地区的GMP法规、要求和指南,美国、加拿大、英国、欧盟和PIC/S的卫生当局在GMP中没有给出这些术语的定义。 检查(check)、审查(review)、核实(verify)这几个词中的共同概念是,卫生当局希望有一个确认,即某件事已经做了,而且已经做得正确。 然后是两个关键问题,(1)这些词各是什么意思?还有
(2)如果它们指的是不同的东西,那么它们将如何应用?
基于风险的思维能帮助我们理解它们的用途吗?
对于许多行业来说,“核实”或“验证”是实时完成的事情。 证人通常是同义词-你正在看着某人执行一个关键的活动,以确保它的完成和正确完成。 “审查”或“检查”是指在制药/生物制药中使用的在事实发生后合法进行的术语;它们不需要实时进行。
为什么这么重要?强调数据完整性是其中的一部分。 审查、检查和核实信息有助于确保数据是“可靠和值得信赖的”,这是美国21CFR11中的一项要求-该条例涵盖电子文件和电子签名,但也有概念上适用于纸质文件的要素。 准备充分的文档的其他特性被安排为缩写,称为ALCOA-plus。
定义关键术语
由于在美国、加拿大和欧盟的GMP要求中没有“官方”定义,我们可以看看行业实践,看看它是如何将这些词付诸实践的(表2)。
表2 经常用来提供对某项被正确执行的活动的信心的术语
所有这些行动都是“确认”某事是正确的,符合标准或要求,或者采取了适当的行动。
验证、审查和检查意味着上没有明确的GMP定义,并且一些监管机构区分记录中的关键术语和非关键术语。我们如何将基于风险的思维应用于什么是“确认” ? 或者,换句话说,你真的需要什么程度的信心,一个行动或事件发生,或记录的数据是准确的? 如果一切都保持在同一个高标准,意味着一切都很重要,那么实际上则是没有一件事是重要的。
表3说明了可以实现确认的方式。
表3。 用于使用基于风险的确认方法的术语
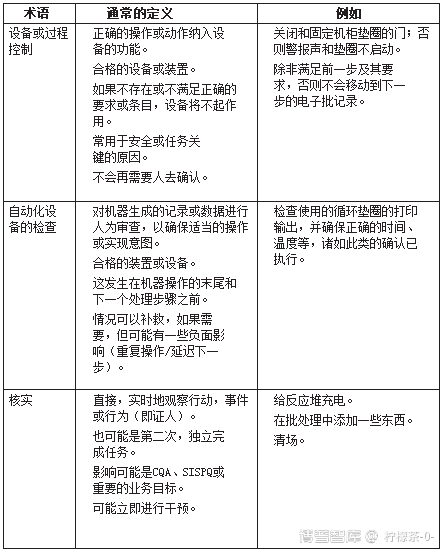
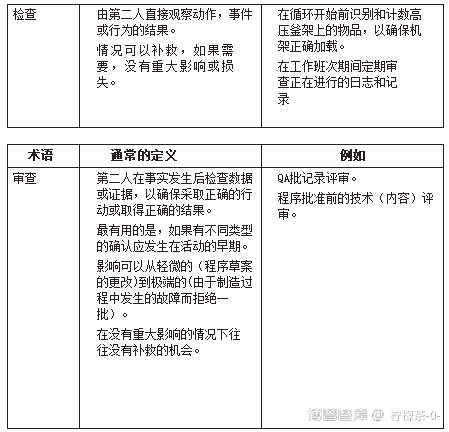
当一个人从设备或过程控制确认的实践列表(表3)向下移动到评审时,严谨性降低,从正在确认的事件(在某种意义上是受控的)到执行的确认之间有更多的时间。如果事件没有得到充分和适当的执行,操作人员(例如安全和健康)、产品和病人的风险也会增加。
如果确实需要确认作为纠正措施,请确保所使用的术语具有适当的严格性,基于想要确认的内容的风险。
资质确认和验证在哪种情况下适合于纠正措施?
设备资质和工艺验证已深深扎根于全球GMP。 这些活动的两个有用定义是:
设备资质:证明任何厂房、设备和支持系统正确工作并实际导致预期结果的行动(WHO,2016年)。
过程验证:从过程设计阶段到商业生产的数据收集和评估,建立了科学证据来证明一个过程能够始终如一地交付优质产品(FDA,2011年)。
那么,资质确认和验证是否适合选择作为纠正措施? 简单地说,不。 资质确认提供文件证明,参与纠正的设备或仪器按预期执行(即达到预定的规格);验证提供类似的证据,证明操作或活动的结果一致导致预先确定的结果。 因此,资质确认和验证不是纠正措施,而是可以作为有效性的证据(见第15章)。
当你无法阻止的时候,试着管理
在研究如何防止经常被定义为“人为错误”的行为时,你可能会发现自己处于死胡同:因为可能没有有效的解决方案。在这种情况下,寻找管理这些事件的方法。
错误管理包括三个阶段,每个阶段描述如下。
1.错误检测:观察或确定一个错误已经或即将发生。
2.错误恢复:以使情况恢复到可接受的状态的方式对情况作出反应。
3.容错:具有足够可靠的系统,保证不产生故障情况。
一个例子可以让我们经历这三个阶段:我开车从我家到机场,通常是一次快速的12分钟的旅行。 在这个特殊的日子里,我没有在我常去机场的街道上右转,而是直接往前走。 穿过十字路口,我意识到我要去的是健身房,而不是机场。 错误检测-识别我的错误-是非常快速和有效的。我知道前面是另一条街,可以把我送到机场。我继续往前走,向右转,在这条平行的路上没有任何问题。错误恢复刚刚发生。不幸的是,在行驶一英里后,由于道路建设,出现了改道。 我不担心,因为,不管出于什么原因,我有额外的20分钟,然后我不得不出现在我的航班;这不是时间紧张的一天。 我能够容忍最初的错误。
错误管理是一个有用的概念,包括程序或在职培训。在可能的情况下,有一个批准的选项,以及操作者可以用来快速检测问题的线索或信号。 而且,在时间、材料和设备方面具有一定的灵活性是很重要的,所以“备用计划”可以在不造成太多延迟或焦虑的情况下实施。
当根本原因找不到的时候
在有些情况下,尽管调查人员作出了辛勤努力,却无法找到根本原因;他们可能已经查明了“可能”的根本原因。
在这些情况下,使用培训作为纠正措施,尽管没有确凿的证据表明缺乏知识和技能造成了问题,是一种浪费。 此外,修订程序不太可能是一项有效措施。
如果无法确定明确的根本原因,则可采取的行动是,如果事件再次发生,可减轻(即减少影响)事件,并设法收集更多可能导致确定根本原因的数据)。 (请参阅第16章,以了解在撰写报告时如何强化这一点。 )
短期与长期
重大的纠正行动往往需要数月才能开始运作。大型项目通常需要几个月,如果不是几年,才能完成大量的任务,如文件要求;设计、订购、安装设备或建筑设施;以及进行资质确认。在此期间,人们仍然必须考虑如何防止问题再次发生。
在纠正措施计划中,需要特别指出和详细说明临时控制措施。 这可能涉及额外的检查步骤、额外的一两个人或程序,或可能在相对较短的时间内足够但实际上无法持续的程序。 临时控制也必须经过变更控制过程。
有一个与这些纠正行动相关的时间表将不仅有助于规划,而且有助于减少卫生当局可能有的任何关注。
纠正措施的残余风险
风险管理中有一个称为剩余风险的概念,即控制措施到位后仍然存在的风险。 这个概念同样适用于当正在计划和实施纠正措施的时候。
识别残余风险可能不一定需要任何类型的正式风险评估,但问一个简单的问题“如果...怎么办?”或“在将这种纠正行动付诸行动时会出什么问题?”可能就足够了。
然而,我们确实知道应考虑的一些常见的残余风险。 其中包括:
警报疲劳:如果你曾经作为病人或访客在急性护理医院呆过一段时间,你就知道这不是一个休息的地方。 蜂鸣声、警报声、闪烁灯、警报器和自动声音都导致了一种杂音,这种杂音被证明实际上会导致病人的不良结果(Sendelbach等人,2013年)。专业的护理人员经常调整自己适应这种情况,因为他们是一般背景噪音的一部分。 在其他情况下,人们可能会忽略实际的警报,因为有太多的虚假警报,通常人们经常假设这是设备的问题。 在制药行业发生的一个有趣的案例是一家制药公司的配送中心发生了一次重大盗窃。
小偷在风暴中触发了三次警报,警报公司每次都通过访问来响应。在第四次触发时,警报公司没有作出反应-他们认为风暴造成了虚假警报;小偷采取了行动,偷走了近8000万昂贵的药物产品(N PR,2010年;Mahoney,2012年)。
没有真正理解控制:一些纠正措施是在没有彻底了解它们实际工作的情况下实施的。 它变成了事情发生的“黑匣子”。 这方面的一个例子是所谓的高斯Copula函数(图1)。 这个数学公式多年来被金融机构用来计算他们的风险水平。 在每一个工作日结束时,计算机都会进行计算,得出一个数字,管理层将用作衡量其财务风险和风险的相对尺度。 这位数学家开发并发表了一篇描述该公式的技术论文,他说,它在某些条件下被证明是有效的,但他没有证据表明它在其他条件下的表现,特别是当所有资产类别都平行移动时。 在2008-2009年的金融危机中,所有的事情都在迅速下降。 然而,机构正试图使用未经验证的、不适当的工具来确定其风险(Krantz,2009年)。 了解某件事是如何真正起作用的,对于降低整体风险很重要。
图1 高斯Copula函数(Krantz,2009年)
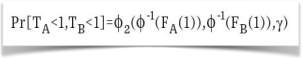
对技术的过度依赖:
变更控制不足:
组织阻力:
可持续性:
结论
为了有效,纠正措施需要与根源和近端原因保持一致。 幸运的是,根据所发现的情况,可以采取一些不同的方法。 如果没有找到原因,努力应该强调如何检测事件是否再次发生,并保护有价值的东西。
参考资料
ASQ (Undated) What are the five S’s (5S) of lean? https://asq.org/
quality-resources/lean/five-s-tutorial. Accessed 26 Mar 2020.
Carr, N. (2014) The Glass Cage: Automation and Us. New York, NY: W.
W. Norton and Company.
FDA (2011) Guidance for industry process validation: General
principles and practices. https://www.fda.gov/files/drugs/published/
Process-Validation--General-Principles-and-Practices.pdf. Accessed
27 Apr 2020.
Gaines, K. (2019) Alarm fatigue is way too real (and scary) for nurses.
Aug 19, 2019. https://nurse.org/articles/alarm-fatigue-statisticspatient-
safety/. Accessed 8 Feb 2020.
GHTF (2010) Quality management system – Medical Devices –
Guidance on corrective action and preventive action and related
QMS processes. Global Harmonisation Task Force. http://www.
imdrf.org/docs/ghtf/final/sg3/technical-docs/ghtf-sg3-n18-2010-qmsguidance-
on-corrective-preventative-action-101104.pdf. Accessed
27 Apr 2020. NOTE: The work of the now-defunct Global
Harmonisation Task Force became part of the International
Medical Device Regulators Forum (IMDRF) in 2011.
Krantz, J. (2009) Recipe for disaster: The formula that killed Wall
Street. https://www.wired.com/2009/02/wp-quant/.
2020.
Mahoney, E. (2012) Feds say they crack $80 million drug heist from
pharmaceutical warehouse in Enfield. https://www.courant.com/
news/connecticut/hc-enfield-eli-lilly-drugs-0504-20120503-story.
html. Accessed 4 Mar 2020.
NPR (2010) Thieves grab $75 million worth of Eli Lilly pills. Mar
17, 2010. https://www.npr.org/templates/story/story.php?storyId=
124758613. Accessed 3 Mar 2020.
Reason, J. and Hobbs, A. (2003) Managing Maintenance Error. Boca
Raton, FL: CRC Press/Taylor and Francis Group.
Sendelbach, S. and Funk, M. (2013) Alarm fatigue: a patient safety
concern. AACN Adv Crit Care, 24(4):378–86.
Shappell, S. and Wiegmann, D. (1997) A human error approach
to accident investigation: The taxonomy of unsafe operations.
International Journal of Aviation Psychology. 7:4, pp. 269–271.
Thaler, R. and Sunstein, C. (2009) Nudge: Improving Decisions about
Health, Wealth, and Happiness. New York, NY: The Penguin
Group.
WHO (2016) [Draft] Guidelines on validation. Geneva: World Health
Organization. https://www.who.int/medicines/areas/quality_safety/
quality_assurance/validation-without_appendices_2016_05_17.pdf.
Accessed 27 Apr 2020.

