一致性评价工作促进了科学研发。今天,作者就分享几个案例,大家可以在工作中借鉴案例中的方法和思路,相信能对大家解决平时工作中的类似问题有所帮助和启发。
案例1:一种确定制剂中API晶型、粒度、粒子形态的新方法
药物的晶型和粒度有时对于BE的影响很大,粒子形态会影响粉体的流动性和可压性。因此在处方前研究中、质量研究中经常遇到的问题是如何判断参比制剂中API的晶型、粒度、粒子形态。对于药物占比较大的,辅料干扰小的,采用XRD法可以进行对比判断晶型异同,如果干扰大,该方法就不合适了。分析参比制剂的粒度和粒子形态是难点,目前常见的方法有:根据文献报道原研粒径的控制;逐步去除辅料后采用显微分析或粒度分析的方法;根据多条溶出曲线对比或者结合预BE结果进行分析和调整的方法。
作者向大家分享Morphologically-Directed Raman Spectroscopy (MDRS)法,文献报道该法在研究API晶型、粒度、粒子形态、处方中特定组分信息(解析处方)等方面具有一定价值,是研究粉体表征时一个有用的工具。该设备较贵,在国外应用较多,目前在国内应用的较少。
马尔文公司的Morphologi G3-ID、Morphologi 4和Morphologi 4-ID全自动静态成像系统将静态成像系统与拉曼光谱集成到一个分析平台上,可以对混合物中的不同颗粒进行化学成分鉴定,可快速、自动地测量颗粒大小、粒径分布、颗粒形状以及化学成分,可在一定程度上节约研发时间,特别是在鼻喷制剂、半固体制剂的开发中。
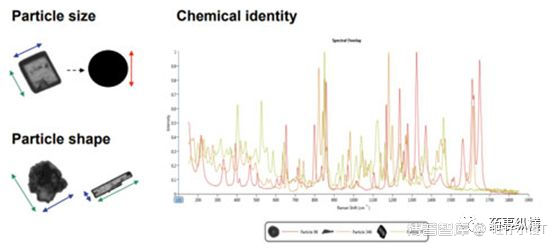
例如,文献[1]采用Morphologi G3-ID通过自动成像和拉曼光谱可以很方便的找到样品中的API,进而确定晶型,如本例中乳膏中的acyclovir 3:2 hydrate form的确定。
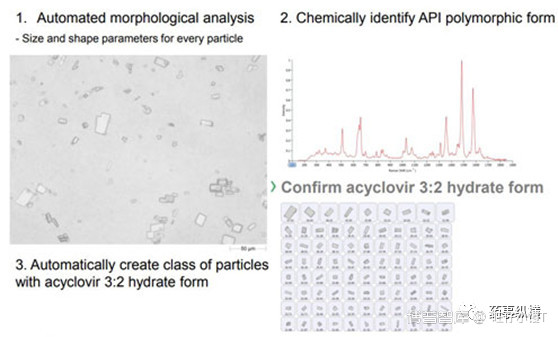
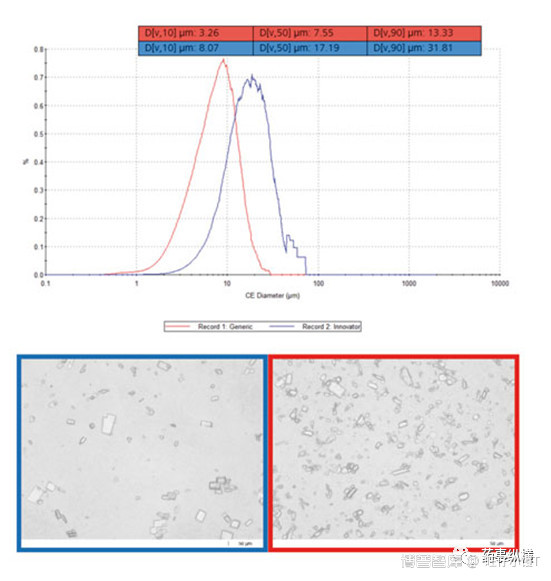
此外,该法可以确定API的粒径,如参比制剂为蓝色,仿制药为红色。本例中仿制药的粒径要比参比制剂小,这可能会影响生物利用度。
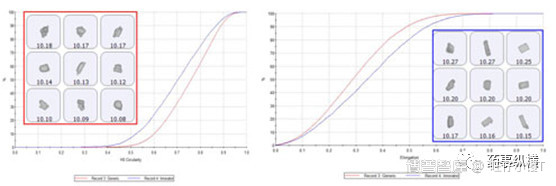
由下图可见,仿制药(红色框)中API的形状比参比制剂(蓝色框)圆、短。尽管晶型相同,但其中的粒子形态和粒度分布是不一样的。
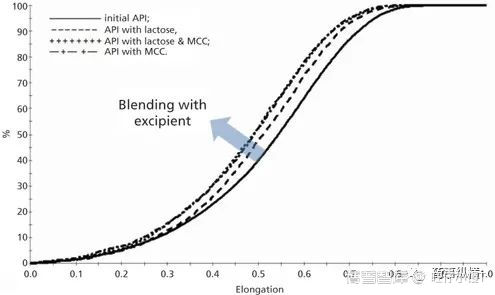
此外,MDRS法还可以用于研究固体制剂生产中哪个工序会对API粒径分布或粒子形态造成影响,如下图所示,混合工序对API的粒子形态造成了影响,说明API在混合过程中发生了破碎[2]。
分享:仿制药开发中遵循的一般原则是仿制药与参比制剂的辅料种类(Q1)相同、辅料用量(Q2)相似,关键质量属性(Q3)一致。前两者往往容易达到,但是Q3做到并不容易,因为受很多参数的影响,如晶型、粒度、粒子形态(晶癖)、辅料级别、来源、设备、工艺及过程参数控制等。研发人员应关注行业技术的快速发展,了解新技术,在研发中适当加以利用,提高开发效率。仿制药的晶型可以与参比制剂相同,也可以不同,目前测定晶型的方法有XRD法、显微镜法、热分析法(DCS、TGA)、熔点法、光谱法(IR、拉曼、固态核磁),MDRS法在制剂晶型研究中是一个值得探索使用的方法。
案例2:注意USP标准中规定的细节参数
本例中的他克莫司胶囊(Tacrolimus)于1994年获得FDA批准上市,随后又有多家仿制药获得批准。USP标准中规定了多家仿制药的溶出方法,共有5种,test 1~test 5。其中在样品溶液中有几个注意点:
方法1中规定:
Sample solution: Pass 10 mL of the solution under test through a G4 glass filter. To 5.0 mL of the filtrate add 2.0 mL of acetonitrile, and mix. Allow the solution to stand for NLT 1 h at 25° before use.
本法介质中不含SDS。规定样品溶液采用G4玻璃滤膜滤过,且室温下至少放置1h后使用。
方法2中规定:
NOTE—Allow the Standard solution to stand for 3 h at ambient temperature before use.
Sample solution: Pass aportion of the solution under test through a suitable filter.
本法介质中含有SDS。规定对照品溶液在室温下放置3h后使用
方法3中规定:
Sample solution: Pass aportion of the solution under test through a suitable filter.
本法介质中不含SDS。规定样品溶液采用适当滤膜滤过。
方法4中规定:
Sample solution: Pass aportion of the solution under test through a suitable filter.
本法介质中不含SDS。规定样品溶液采用适当滤膜滤过。
方法5中规定:
Sample solution: Centrifuge a portion of the solution under test. Use the supernatant.
本法介质中不含SDS。规定样品溶液采用适当滤膜滤过。
为什么USP标准中关于对照品溶液和供试品溶液有如此特殊规定呢?
他克莫司是难溶性药物,制剂采用无定型固体分散体技术来提高溶解度。USP标准虽已提示了在做溶出度时的一些注意事项,但操作中应注意哪些细节,为什么要这么规定,仍然需要结合本品的特殊生产工艺进行思考。
表1数据说明了滤膜材质/孔径对溶出度结果的影响。1.2µm和10µm的滤膜都是pass,只有0.45µm滤膜fail,说明滤膜孔径对结果影响很大。小孔径滤膜可以阻拦药物通过滤膜。进一步通过观察发现,溶出液中有悬浮粒子。
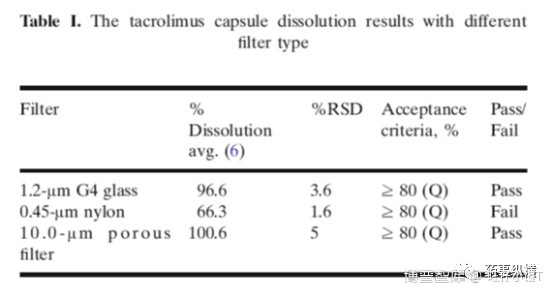
表2数据说明没有过滤立即进样测定后与过夜结果对比,溶出结果有重大差异。前者fail,后者pass。说明放置一段时间后样品还会继续溶出。对于没有加表面活性剂的溶出介质而言,需要严格按照标准操作,否则会出现异常结果。
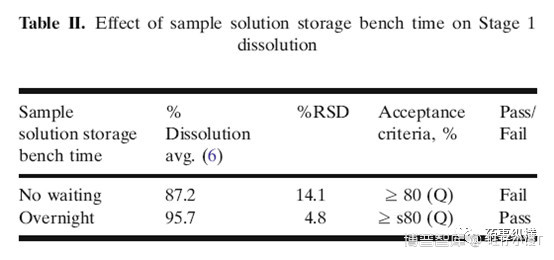
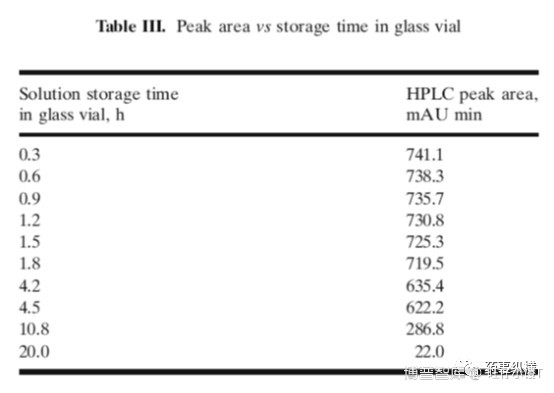
表3、4数据列出了不同材质的样品瓶,如玻璃与聚丙烯(简称PP)对溶出结果的影响。
从表3可见,随着放置时间的延长,峰面积一直在下降,20h时基本检测不到了。
从表4可见,PP材质的样品瓶对结果影响不太大,不同批次间无明显差异,API与PP瓶无相互作用。
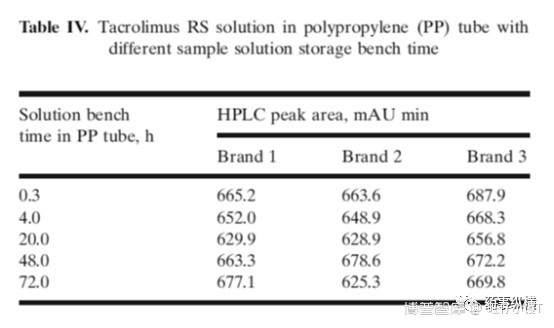
相互作用与什么有关呢?经研究发现,相互作用与溶液的pH有关。不同pH溶液中的API在玻璃样品瓶中的峰面积有显著差异,低pH时稳定性好于高pH。
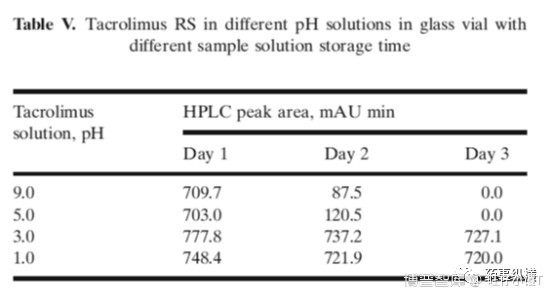
如何解决这个问题呢?作者采用不同pH的溶液对玻璃样品瓶进行去活处理。方法为:用不同pH溶液充满样品瓶,放置10min,倒出溶液,室温下倒放干燥。结果表明,经pH1.0去活的玻璃样品瓶无相互作用。
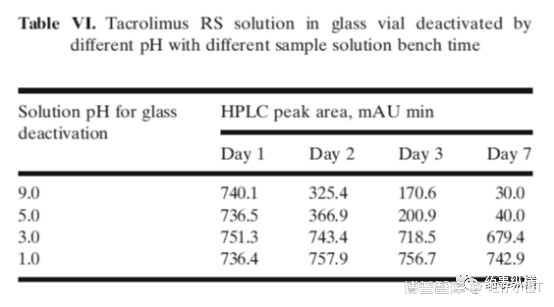
文章最后,作者建议可采用PP样品瓶代替玻璃样品瓶进行HPLC分析,尽量使用PP材质管路,弃去至少2ml的溶出液或使用G4或适当滤膜,对于玻璃溶出杯可采用酸溶液进行去活处理,对照品溶液和样品溶液应采用USP推荐方法操作。这些控制措施是保证结果准确的细节参数!
分享:采用国内外标准进行检验时,对于那些特殊规定或备注,一定要多思考为什么,注意同品种各国标准之间的差异和共同点,在充分的文献调研和整理的基础上开展对比研究。要特别注意对异常数据的分析与积累,不要轻易放弃一个有价值的问题。溶出度测定操作不仅仅是把药片投入到溶出杯中测出数据,其中还有很多的参数、过程细节需要注意,例如溶出行为(现象、状态、手感等)、峰面积规律性变化的异常值等。在溶出度方法学验证中应结合产品实际情况进行针对性的研究和验证。
案例3:多个降解杂质出现时,如何判断某个是否显著的?
在降解试验中经常会发现在某些条件下出现了几个比较大的降解杂质,由于降解试验可以为方法开发、特定降解杂质研究、稳定性研究等提供有价值的参考,因此需要特别关注。对于某些较大的降解杂质如何分析,是否需要对其进行结构鉴定、分离制备或者订入标准?下面我们对辉瑞(Pfizer)公司早年发表的一篇文章中的案例进行简要分析[4]。
文中列出了降解试验中的杂质显著性判断的原则:
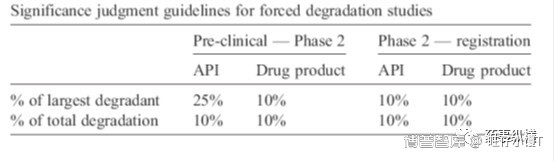
Example 1: A degraded sample from an exploratory API forced degradation study shows 25% main band loss. Analysis shows a major degradant (16%), a second degradant (3%) and several further degradants at levels NMT 2%.
本例中API有25%的降解,主要降解杂质16%,次降解杂质3%,其他低于2%。
16%峰是最大的降解杂质,占总降解杂质量的60%,因此判为主要降解杂质;
3%峰由于没有超过10%,且低于最大降解杂质的25%,因此判为不显著杂质;
低于2%峰由于低于10%,且低于最大降解杂质的25%,因此判为不显著杂质;
Example 2: A forced photodegradation experiment results in 10% main band loss. Many individual degradants are observed, of which the largest is 0.8%.
本例中API降解了10%,出现了很多降解杂质,最大0.8%。因为没有超过10%,因此判为不显著。
分享:在phase 2阶段,如果一个降解杂质占总杂质的百分比超过了10%,且与最大降解杂质的百分比超过了25%或10%,认为该杂质是显著降解杂质。在仿制药研究中,在未开展加速、长期试验前,由于仿制药与参比制剂的处方组成(辅料比例、质量)或工艺可能存在不同,因此可以结合降解试验或影响因素试验进行对比研究,发现可能出现的主要降解杂质,提前进行预判、结构分析、杂质制备、校正因子测定等工作,为可能出现的情况做准备。在判断哪些杂质需要进行针对性研究时,可以借鉴上表中的思路进行分析,有选择性的进行研究。
参考文献:
P. Kippax, J., and C. O’Grady, " Testing Topicals: Analytical Strategies for the In-Vitro Demonstration of Bioequivalence," Pharmaceutical Technology Europe APIs, Excipients, & Manufacturing 2018 (September 2018).
C. Langley, “Morphologically-Directed Raman Spectroscopy: Uncovering the Good, the Bad, and the Ugly in Drug Formulations,"Pharmaceutical Technology41 (4) 2017.
Kui Zeng, Zongming Gao, Michael Trehy, and Wenlei Jiang. Dissolution Test of Tacrolimus Capsule: Effects of Filtration and Glass Adsorption. AAPS Pharm Sci Tech, Vol. 19, No. 2, February 2018
Karen M. Alsante , Akemi Ando , Roland Brown , Janice Ensing , Todd D. Hatajik ,Wei Kong , Yoshiko Tsuda. The role of degradant profiling in active pharmaceutical ingredients and drug products. Advanced Drug Delivery Reviews 59 (2007) 29–37
文章来源:药事纵横

