欧洲药品管理局(EMA),作为一个成立时间相对不长,却成长迅速的公共卫生机构,已成为药学工作者日益关注的重点对象之一。可以说,在全球范围内,其监管能力和权威性整体仅逊于美国FDA,故了解EMA的成长史、了解其组织结构,并对其日常工作内容、政策、指南等加以学习与思考,日积月累,对于药物研发来说,将受益匪浅。
1、欧洲药品管理局(EMA)简介
1993年,欧盟(EU)委员会根据同年7月22日通过的(EEC) No.2309/93号法规,建立了欧洲药品评价局(European Medicines Evaluation Agency,EMEA),总部设在伦敦。
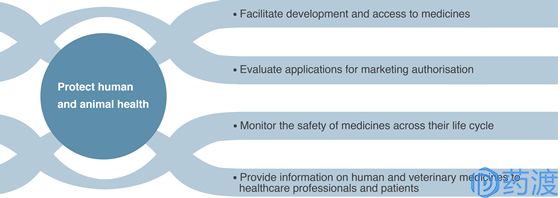
EMEA于1995年1月1日正式开始运作,其职能是负责协调提交到委员会的药品科学评价意见,在欧盟内监督药品使用的安全性和有效性,协调、监督、检查GMP、GLP、GCP,并在欧盟内部促进科学技术的发展和交流。作为欧盟医药产品的审评机构,其工作重点在于促进药物的创新与开发,使患者更快获得安全、有效的药品。
且负责欧洲经济共同体全部成员国的公共健康问题,确保药物的安全性、有效性以及高质量,其服务范围为超过5亿人口的欧盟地区市场。2004年4月30日,在颁布的(EC) No.2004/726法令中,在保持EMEA标识和基本职能不变的前提下,将EMEA更名为EMA (European Medicines Agency),沿用至今。
图1:欧洲药品管理局工作目标
2、组织结构
EMA的总体管理机构为管理委员会,其具有监督职能,负责任命执行理事,执行理事下属领导及部门为执行副理事和咨询部门,再下属7个部门分别负责“人用药物研究开发”、“人用药物评价”、“人用药物警戒”、“兽药”、“利益相关者有效沟通”、“信息管理”、“行政企业管理”,其组织结构图如下:
图2:欧洲药品管理局组织结构

☆管理委员会
管理委员会是EMA的总体管理机构,具有监督职能,负责执行理事的任命,以及整个EMA体系的计划、预算等工作事项。委员会服务于公共利益,不代表任何政府、组织和部门,由36名成员组成,其中包括每一个欧盟成员国的代表(共28个)、欧盟委员会的2名代表、欧洲议会的2名代表、患者组织的2名代表、医生组织的1名代表、兽医组织的1名代表。
☆执行理事
执行理事为EMA的法定代表,负责监督机构工作人员的日常工作。
图3:现任执行理事~GuidoRasi教授

3、7个科学委员会
EMA共有7个科学委员会,主要通过向新药研发公司提供科学建议、出台指南、监督指导,来帮助制药公司完善产品的上市申请,他们分别是:人用药品委员会、药物警戒风险评估委员会、兽药委员会、孤儿药品委员会、草药产品委员会、先进疗法委员会和儿科委员会。此外,还有一些从事相关科学工作的组织。

☆人用药品委员会(CHMP)
CHMP主要负责人用药品注册审评中科学与技术方面的问题,在欧洲市场药物许可的审核过程扮演着重要的角色,执行一套全区认可的药品评估方法(Directive 2001/83/EC)。根据欧盟法律2001/83/EC,CHMP负责对上市前药品进行评估、对上市后药品进行管理、对各成员国有关药品的不同意见作出公断,如有必要,也将向欧盟委员会申请药品的停止销售与撤市。CHMP会对每个申报的品种作出一份欧洲公共评估报告(EPAR),为药品添加标签、包装、SPC及评估细节,为公司提供新药开发技术帮助,进一步为行业制订指南方针,并通过国际合作保证药品的规范化。
☆药物警戒风险评估委员会(PRAC)
PRAC是根据2012年生效的药物警戒立法而正式建立的,其目的是加强欧洲药品的安全监测,是EMA负责评估及监测人用药物安全事务的科学委员会。PRAC负责评估人用药物风险管理的各个方面,如负责对产品有效性的检测;在确保药物疗效的前提下,对不良反应进行风险评估、监测,从而实现风险最小化;设计、评价药品授权后的安全性研究,等等。
☆兽药委员会(CVMP)
CVMP主要负责兽药注册审评中科学及技术方面的问题,在欧洲市场畜用药物认证许可的审核过程中扮演着重要的角色,其任务是协助EMA准备所有与动物用药有关的意见和建议。在欧盟地区统一管理方面,兽药委员会还负责申请进入欧盟市场动物药品的初步评估和一些后续追踪工作。
☆孤儿药品委员会(COMP)
COMP源于1999年欧洲议会通过的孤儿药法规(2000/141/EC),该法规主要包括制定孤儿药认定程序、界定已认定的孤儿药研发与上市的激励措施,成立专门负责孤儿药审核、认定的孤儿药品委员会(COMP)。该委员会主要负责对孤儿药申报的审核,以及对欧盟执委会在建立孤儿药的政策与实施办法过程中提出科学性的建议。
☆草药产品委员会(HMPC)
HMPC主要负责提供EMA对草药的意见,主要功能是协助欧盟各国整合草药产品的审核和提供相关咨询帮助,目前根据《欧盟传统植物药(草药)注册程序指令》(2004/24/EC),草药产品在欧洲注册和上市共有3种程序,分别是传统使用注册、固定使用注册,以及单独/混合申请注册。为促进欧盟草药注册程序和草药物质信息的统一,HMPC编写了传统和固定使用草药令著,制定了传统草药的物质、制剂和复方的目录。草药令著不仅包括HMPC对草药物质及其制剂的安全性和有效性的科学意见,还包括HMPC科学评估时的所有信息;而相比于欧盟草药令著,传统草药的物质、制剂和复方的目录对申请者和成员国监管当局均具有法律约束力。
☆先进疗法委员会(CAT)
CAT是根据欧盟新兴医疗产品条款(Regulation (EC) No1394/2007)而建立的,主要任务是在CHMP审核决定前,为各种新兴医疗产品(ATMPs)的申请提出全面的科学意见,而所谓ATMPs,是指源于基因、细胞和组织的药品。所有的ATMPs都由EMA集中许可,它们受益于单一的评估和许可程序。在ATMPs的审评过程中,CAT会对每一个ATMP申请准备草案意见,然后送交给CHMP,CHMP在此基础上给EC提供批准或拒绝上市许可的建议,最后由EC做出最终决策。CAT还参与EMA针对研发ATMPs的SMEs的质量和非临床试验认证,并就ATMPs的分类提供科学建议。
☆儿科委员会(PDCO)
PDCO源于2007年欧盟药品法规(2006/1901/EC)的实施,该法规规定了一系列EMA关于儿科药品发展的重要工作和职责,涉及儿科药品的开发和许可等问题,极大改进了儿科药品的监管环境。其工作主要包括质量、药效或安全性方面的资料评估、搜集儿科方面用药信息、协助EMA建立关于儿科药物研究的专家网络、提供儿科用药方面问题的咨询、编列更新儿科用药需求目录、提供EMA和欧盟执委会在儿科用药信息研究方面的咨询,等等。
4、EMA药品审评程序
首先,药品在欧盟经济区上市可通过两种方式进行,“集中授权”和“国家授权”。集中授权方式走集中程序,即药品通过EMA的上市许可后,即可在所有欧盟成员国上市,对应的审批程序是针对整个欧盟市场的"集中审批程序"。而国家授权方式对应的注册程序包括"非集中程序"、各成员国之间的"互认程序"和成员国自主的"成员国审批程序"。这里主要讲下集中审评程序,以及企业如何申报。
☆集中审批程序(CentralisedProcedure,CP)
对于集中审评,其药品范围包括:所有生物技术及其它高科技工艺制备的人用药品和兽药产品,如治疗艾滋病、肿瘤、糖尿病、神经退化(痴呆症)、自身免疫疾病及其他免疫障碍及罕见病的含新活性成分的人用药物;用于促进动物生长、增加动物收益的兽药;根据Regulation (EC) No141/2000定义为孤儿药的药物;等等。上述以外的其它创新药物,企业也可向EMA递交集中审评申请。符合上述规定的药品申请人要想一次注册药品投放整个欧盟市场,应将注册申请直接递交EMA,由其下属的CHMP或CVMP进行审评,这两个委员会每月会召开一次会议。
☆企业上报申请-审评程序
上市许可申请所有材料送交EMA审评员审评(负责的正副审评员由EMA主管科学委员会指定),整个审评过程的协调和审评报告草案起草由审评人员负责。他们自行或召集其它专家共同完成审评后,起草出评估报告的草案。期间,审评员要就报告中的说明及提到的缺陷与申请人沟通,并对注册申请人的答复进行评估,并将有关材料送人用药品委员会或兽药委员会讨论。解决有争议的意见和问题后,起草最终评估报告。审评工作完成后,制作初稿意见,而后由CHMP采用并作出授权与否的决定。集中审评的期限是210天,批准的上市许可证有效期为5年,申请人要在许可证失效前的9个月提前提出延期申请。
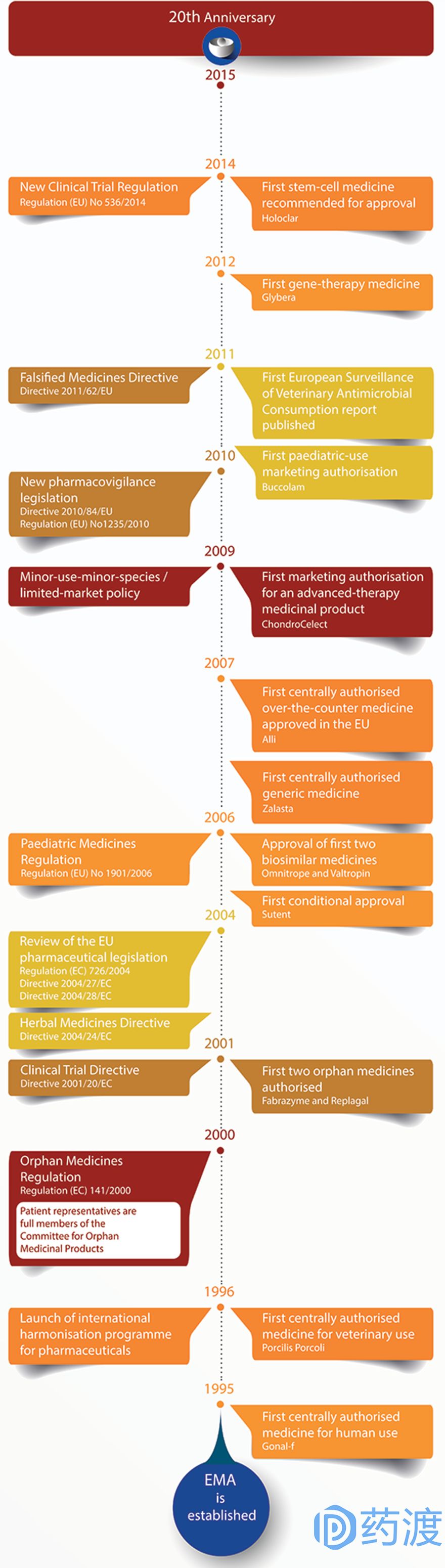
5、EMA里程碑事件
1995,EMA成立;
2000年,颁布孤儿药法规,成立孤儿药品委员会;
2001年,颁布人用药品法令、兽药法令和临床试验法令;
2004年,颁布草药法令;制定欧洲生物仿制药法规;
2006年,颁布儿科药品法规;
2007年,颁布先进治疗医药产品法规;
2010年,颁布药物警戒法令和法规;
2012年,药物警戒和风险评估委员会(PRAC)的成立;
2014年,患者首次就人用药品委员会(CHMP)内的药物进行风险-获益评估。
2015年,EMA成立20周年。
图4:EMA大事件
参考:
1. EMA官网http://www.ema.europa.eu/ema/
2. 知网数据

