本人首先申明,以下内容,是笔者在制药厂质量技术中心QC实验室的质量管理分析、经验分享,与各位同行互相学习交流,取长补短 ,希望可以帮助在分析岗位的各位同行们!
一、可疑数据分类与定义:超标检验结果:超常检验结果但不符合历史数据的统计学警戒限(μ±3σ)。超期望结果(Out异常数据(Abnormal data,AD):实验室差错(Laboratory Error,LE):
二、异常数据情况产生原因分析如下:(1)检验方法不适用。(2)取样被污染、缺乏代表性或其它取样异常。(3)检测过程异常(4)仪器性能异常或超计量效期使用;(5)试剂、对照品或样品存储或使用不符合要求;(6)使用错误或过期的文件;(7)分析参数偏离既定的方法线性、定量限、耐用性、溶液稳定性等范围;(8)分析批系统适用性、随行对照或样品平行性等数据接受标准不符合要求;(9)有明确记录、痕迹、现象的其它操作失误或偏离。
三、适用范围在工艺验证阶段产生的数据异常与偏差,包括工艺验证用生产物料检验过程的数据异常与偏差,需按《QC超标、超常检验结果处理规程》的规定进行调查,填写《实验室调查报告》。研发阶段在工艺验证前的小试、中试、试产等均属于研究开发阶段,在该阶段生产过程中产生的数据异常与偏差按本规程进行异常或偏差处置。分析人员发现检验异常(如称量错误、配液错误、稀释错误、仪器故障、仪器操作失误、基质效应大、系统适应性不合格等)并在系统考察过程(基质、系统适用性)结束前,在排除异常或上报给QC主任或QC主管,填写异常情况处理登记表,解决设备故障后可自行开始实验。药典或试验方法规定允许进行到下阶段多样品重新分析的检测项(溶出度、含量均匀度等),应优先按药典或法规执行。注意: 产生异常或偏差的实验过程及结果,以及偏差调查过程的实验及结果,均应如实记录
四、实验室调查一般性审核:具体步骤如下:(1)确认图谱、系统适应性、数据平行性、随行对照是否符合要求;(2)确认分析方法被执行情况;(3)确认仪器操作、仪器性能、计量效期是否符合要求;(4)确认对照品、试剂、溶液的来源、规格、有效期、贮存是否符合要求;(5)确认取样与样品贮存过程是否符合要求;(6)对实验记录、技术文件、证明性文件进行回顾性分析,查明是否有相关原因的提示或异常现象的描述;
五、偏差识别:研发阶段检验数据异常与偏差处置表》,并登记《研发阶段检验数据异常与偏差登记表》;偏差单号按“四位年份+三位流水号”原则进行登记。
明显差错的处置:手动积分:离群值剔除:单次复测:调查性复测:原液重新分析:原样重新分析:重新取样分析:
六、
七、数据报告与调查结论数据报告:
八、双值决策树
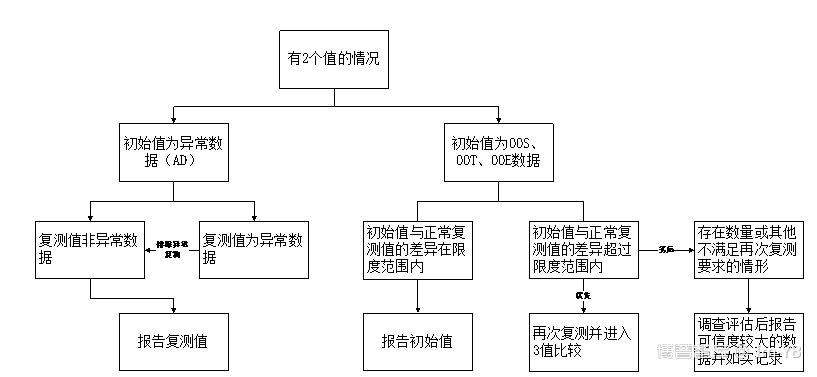

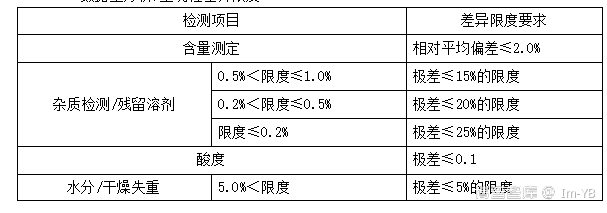
九、数据重分析/重现性差异限度

十、调查结论:
十一、文件归档:《研发阶段检验数据异常与偏差处置表》与产生偏差过程、偏差调查过程相应的经审核的记录、图谱一并由QC主管或QC主任进行归档管理。
以上内容仅供参考!

