2021年7月1日 PIC/S(国际药品认证合作组织)正式发布了PIC/S Guidance PI 041-1 《受监管GMP/GDP环境下的数据管理和完整性良好实践》;
PIC/S PI指南简介
国际药品检查组织( PIC/S) 是国际药品检查领域权威的机构,PIC/S 的检查标准已经成为国际药品生产管理规范( GMP) 检查的金标准和国际通行准则,国际上部分国家间基于PIC/S 检查标准达成了检查互认协议( MRAs)。
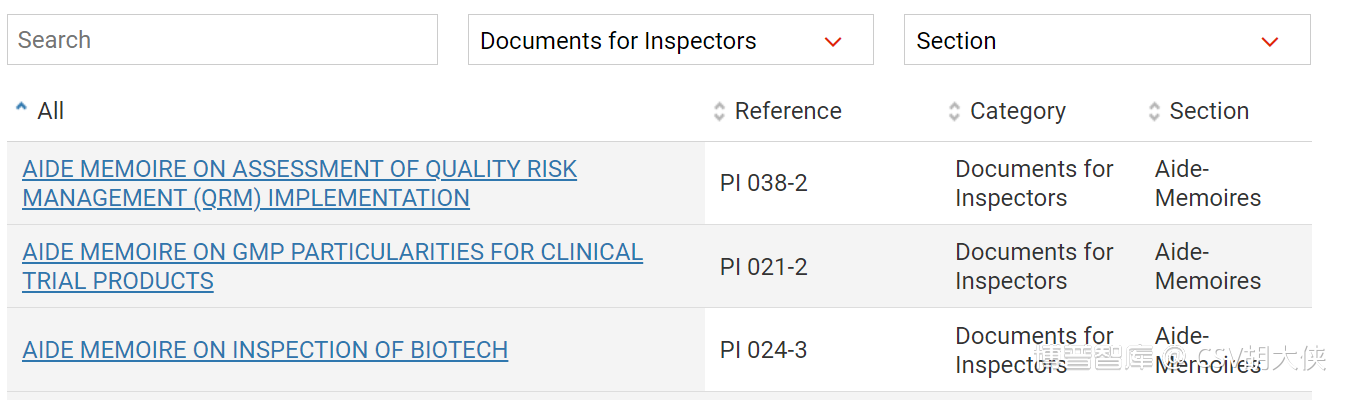
PE前缀PI 检查官培训和现场检查的内部手册
亮点的解读
1.为什么DI 数据可靠性对于现场检查至关重要:

大侠解读:
PIC/S认为,在短暂几天现场检查中,检查的有效性很大程度依靠企业提供给相关证据的可靠性以及基础数据的完整性。在检查过程中,检查员是否可以完全信赖和参考呈现给他们的证据与记录的完整性,这将决定检查的效果。
2.药企的DI Risk 数据可靠性风险有哪些类型?

大侠解读:
PIC/S建议Inspector现场检查中重点关注 Poor Integrity Practices不良的数据可靠性实践【管理上的问题 - 比如共用账号,低级别用户做高风险业务】和PoorIntegrity Vulnerability数据可靠性薄弱点【技术上的问题 – 比如无法禁止数据被篡改和删除】;
因为现在欧美推崇的是ScienceData based quality decision基于科学数据的质量决策,如果“数据-》记录证据-》产品质量
3.企业应该如何应对现场检查中对DI risk数据可靠性风险?
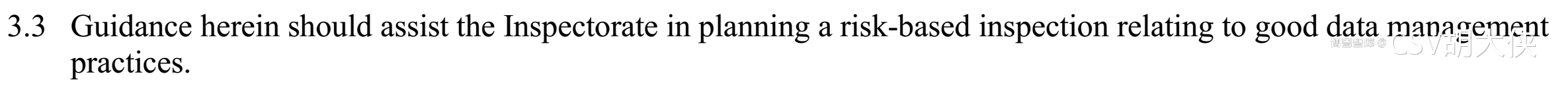
计划现场检查时基于风险,有的放矢

而这就涉及了一个问题 – 如何进行风险评估?PIC/S指南给出建议是:企业进行良好数据管理,不是搞大水漫灌不能片面地对所有GMP业务的DI要求一致不是所有的数据或流程步骤对产品质量和患者安全都有一样的重要性
1.数据本身的关键程度
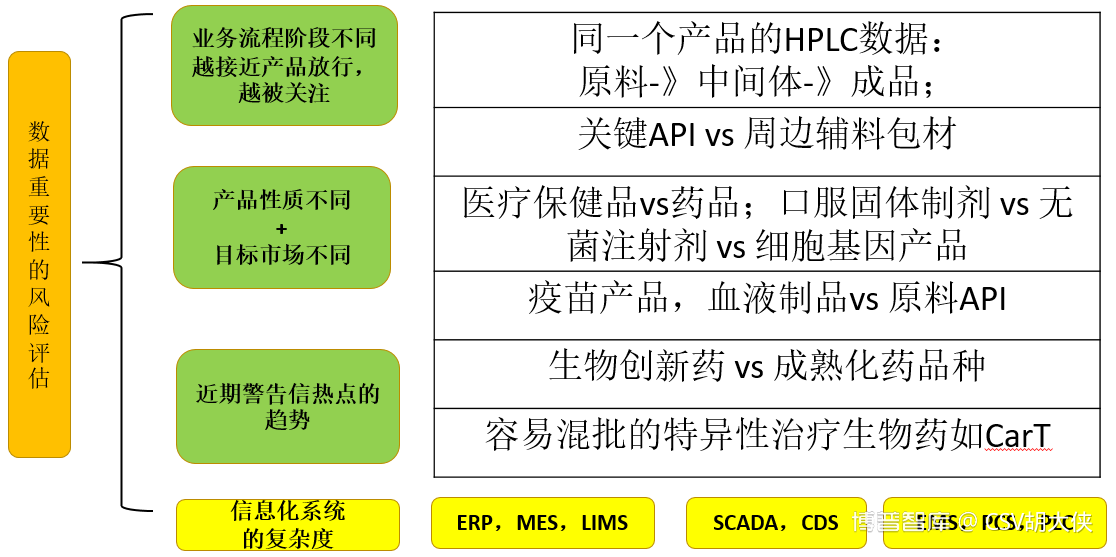
图2. 药视网-CSV课程《计算机化系统风险评估》
2.业务流程中数据的可信度及客观性
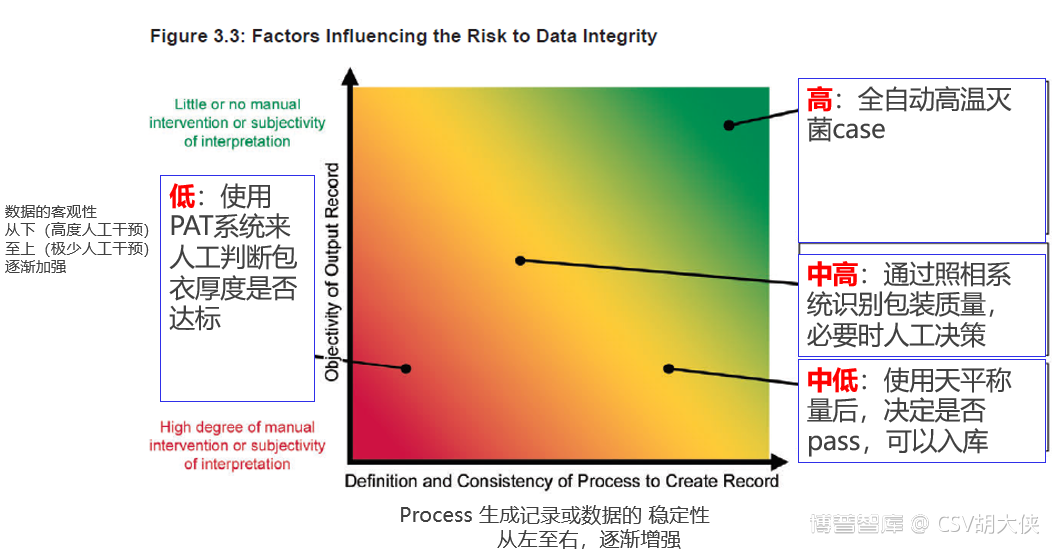
未完待续
参考阅读:
数据风险评估参考 - Data Risk
业务流程评估参考 - Business Process Risk

