两个月前的4月21日,FDA 两位联合发布的关于巴尔的摩新冠疫苗CMO工厂Emergent的公告(疫苗CMO引出的FDA信任危机( 疫苗CMO引出的FDA信任危机)
疫苗CMO引出的FDA信任危机)
6月15日,FDA公布了致Janssen公司的对于上述CMO疫苗的备忘录。其中有几个点,几乎和NMPA的监管理念背离,着实让国内医药人惊讶。难道因为美国没有《疫苗管理法》?备忘录的精彩内容摘录了几条。
Emergent公司是一个拟建的用于生产Janssen公司新冠疫苗的工厂,FDA至今未授权该公司生产;也尚未允许该公司产品销售;目前在美国尚未使用。(未经批准生产的药品?(对了,新药法不按照假药论处了)
2020年8月至2021年4月,该工厂用于AZ公司的新冠疫苗生产。
相关污染事件的时间轴见下图:
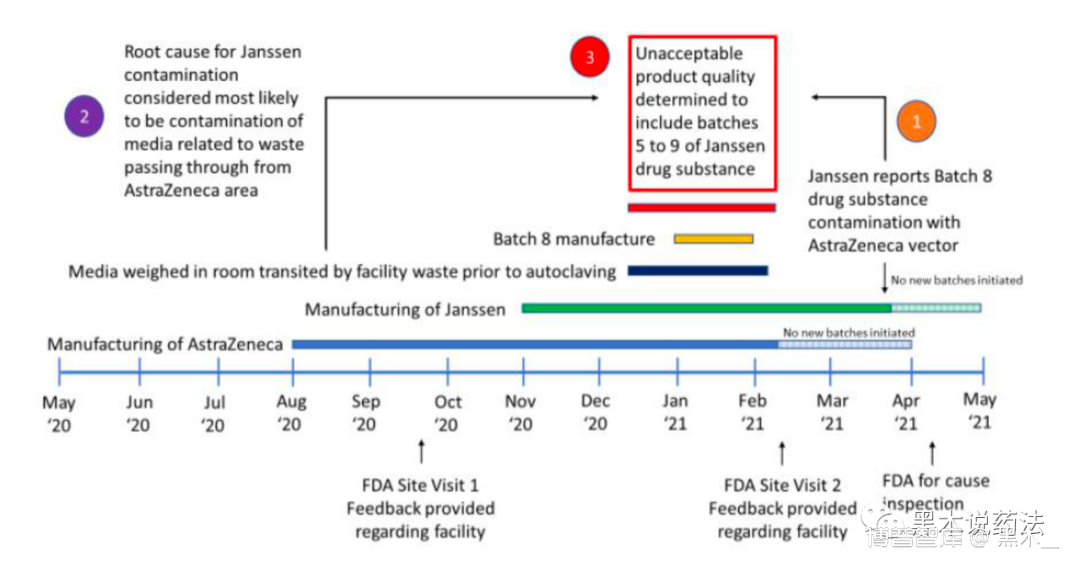
2020年8月,EMOB工厂3区开始生产AZCOVID-19疫苗DS的生产。2020年9月21 日至23日,FDA对EUA27205进行了第一次pre-EUA站点访问。检查发现设施中可能影响任何制造的条件,包括:设备和供应的制造区;质量保证支持不足;以及与实验室控制有关的几个问题。此外,还需要改进物料和设备的传递(后期发生污染的主要原因)。2020年11月,Janssen开始在EMOB工厂的第2区生产新冠疫苗。最初,称重和分配作业发生在区域2,并没有使用共同的称重和分配区域。12月,第2 区(Janssen)和第3区(AZ)的生产开始使用普通的称重和分配区域。2021年2月9日至11日,FDA返回EMOB进行第二次pre-EUA站点访问。当时,人们注意到对许多人员变动和新雇员的关切,以及需要更好的文件和程序,并保持与既定做法的一致性(印证了人是GMP管理中最大风险的理念)。2021年3月26日,Jansen通知FDA,在COVID-19疫苗DS21003600批次中检测到AZCOVID-19(GMP8)病毒(被污染的药品,妥妥假药了)。2021年4月12日至20日FDA进行的原因调查,发出483(对待疫苗CMO,FDA真该学学“四个最严”( 对待疫苗CMO,FDA真该学学“四个最严”)Janssen经过调查不能排除在 GMP5、6、7和9批次中出现AZ疫苗病毒污染的可能性。
对待疫苗CMO,FDA真该学学“四个最严”)Janssen经过调查不能排除在 GMP5、6、7和9批次中出现AZ疫苗病毒污染的可能性。
亮点总在最后,FDA在备忘录最后说,考虑到目前的COVID-19公共卫生紧急情况,已确定GMP第2批次和第4批次适合使用(据调查在交叉污染发生前生产)。根据这一决定,第2和第4批符合EUA标准,并将添加到JansenCOVID-19疫苗EUA27205中,在美国分销并可能出口到其他国家。尽管有人会说FDA是基于风险管理,比国内的强监管更加科学。要不接种一下GMP2、4批,感受下?比较下来,NMPA对于疫苗的管理让我安心很多,至少有那么多的驻厂员在日以继夜的工作着。

