监管期望药品质量管理规范(GxP)领域内的数据与记录是全面的、一致的、可靠的、准确的、保存其内容与含义,并在所需的保存期内可获得与可用,符合ALCOA+原则。
影响数据完整性的具体方面,特别是监管重点与关注的方面包括:缺乏基本的访问控制与安全措施,允许未经授权更改共享用户名登录缺少或禁用审计追踪缺乏对活动的同步记录未能调查数据差异检验直至合格质量决策所用数据的收集、保存与审核不完整覆盖或删除原始数据数据伪造
概述数据完整性管控要点
1.数据完整性和质量风险管理相结合
制药企业应当建立有效数据管理程序,从技术、程序和行为方面确保数据质量和完整性,数据完整性执行要素需要与数据本身的风险性匹配这可能涉及设计控制也可能涉及规程管理。
为管理与数据完整性有关的每个风险,有必要对所有包含系统、流程和GxP数据的组合,可进行合适的风险评估活动,如下表所示:
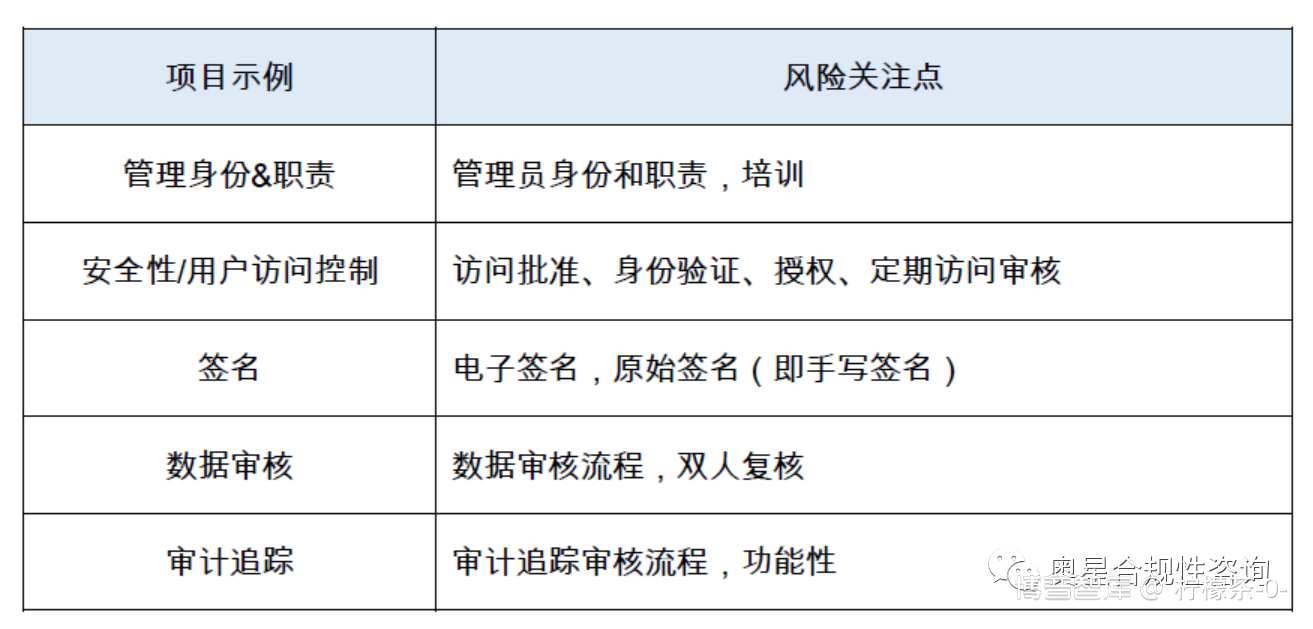
数据完整性风险,特别是可能与产品质量与产品安全性相关的风险,应通过既定的质量风险管理(QRM)流程进行管理,并定义为质量管理体系(QMS)的一部分。这应包括考虑与任何外包活动或使用服务提供商有关的数据完整性风险,这些风险应通过恰当的正式协议进行评估与管理。
2.数据生命周期管理与数据流图
数据生命周期包括从数据的初始创建、处理、使用、保存、检索到最终销毁的所有阶段。每个生命周期阶段都能影响数据完整性。应定义并实施稳健的基于风险的业务流程,并了解数据流。数据流程旨在充分地降低、控制和持续审核与数据的获取、处理、审核和报告步骤相关的数据完整性风险,以及自储存至检索过程中的数据和相关元数据的物理流程。
数据流图应以图形方式说明一个业务流程中数据要素的创建、使用、移动:各活动的“数据”视图。数据流图应显示在每个步骤中受到影响的数据要素(字段、表格或数据库)。数据流图还应使用类似于流程图中的图像来说明操作和决策。
数据流图可用于识别:受活动影响的数据监管要求的数据要素可以重新处理或修改的数据(因此需要审计追踪)正确决策所需的数据数据治理体系
数据治理是不论数据以何种格式生成,确保数据的记录、处理、保留与使用的各种安排的总和,以确保在整个数据生命周期中记录是全面的、一致的与准确的。确切地说,数据治理包括实现一致的、准确的与有效的数据处理所需的人员、流程与技术。
3.整合至质量管理体系
质量手册中应包括一个质量方针声明,以表明管理层致力于一个有效的质量管理体系(QMS)。该方针声明应包括旨在确保数据完整性与全面性的道德守则与适当的行为守则,包括人员向管理层报告任何质量与合规性问题或疑虑的机制。
▶ 培训与教育人为因素是有效的数据治理体系中的一个关键方面,包括文化差异、人为错误、理解与意识,及动机与行为等主题。应为人员提供关于数据完整性原则与方针的重要性的培训。
总结
参考文献:ISPE RDI GPG – Data Integrity - Manufacturing RecordsISPE RDI GPG – Data Integrity - Key ConceptsISPE RDI GPG – Data Integrity by Design

